Inga Kwiecień, Agnieszka Kulig, Agnieszka Szopa, *Halina Ekiert
Nowe surowce roślinne w Farmakopei Europejskiej. Część 4. Houttuynia cordata Thunb. (pstrolistka sercowata) – źródło nowego surowca flawonoidowego
The new plant raw materials in the European Pharmacopoeia. Part 4. Houttuynia cordata Thunb. (chameleon plant) – new flavonoid raw material
Katedra i Zakład Botaniki Farmaceutycznej, Wydział Farmaceutyczny, Uniwersytet Jagielloński, Collegium Medicum, Kraków
Kierownik Katedry i Zakładu: prof. dr hab. n. farm. Halina Ekiert
Streszczenie
Suplement 9.4 do Farmakopei Europejskiej wprowadza kilka nowych surowców pochodzenia roślinnego, znanych od dawna w lecznictwie krajów wschodnio-azjatyckich, a dotychczas niewykorzystywanych w oficjalnym lecznictwie w Europie. W częściach 1 i 2 serii artykułów przedstawiono gatunki dostarczające dwóch nowych surowców saponinowych – Bupleuri radix i Platycodi radix. W części 3 scharakteryzowano Ligusticum chuanxiong – gatunek będący źródłem nowego surowca olejkowego. Natomiast w części 4 zdecydowano przedstawić podstawowe informacje dotyczące charakterystyki botaniczno-ekologiczno-chemicznej Houttuynia cordata – pstrolistki sercowatej. Surowiec pozyskiwany z tego gatunku – Houttuyniae herba, jest od dawna znany i wykorzystywany nie tylko w tradycyjnej chińskiej medycynie (TCM), lecz również w tradycyjnej medycynie japońskiej, tajlandzkiej i nepalskiej. Przeglądowi współczesnych, profesjonalnych badań farmakologicznych ekstraktów z surowca poświęcono najwięcej uwagi. Przegląd ten dokumentuje m.in. niezwykle ważne kierunki aktywności leczniczej surowca – działanie przeciwutleniające, przeciwnowotworowe i przeciwzapalne. W artykule zwrócono ponadto uwagę na znaczenie omawianego gatunku jako środka spożywczego w wybranych krajach azjatyckich oraz źródła surowców kosmetycznych. Celem artykułu jest popularyzacja podstawowej wiedzy dotyczącej tego nowego farmakopealnego gatunku w środowisku farmaceutów i lekarzy.
Summary
The European Pharmacopoeia Supplement 9.4 introduces several new plant-derived raw materials long known in East-Asian medicine but previously not used in official European medicine. A series of articles in Part 1 and 2 presents species providing new saponin raw materials: Bupleuri radix and Platycodi radix. In part 3, the species which is a source of a new essential oil raw material, namely Ligusticum chuanxiong is characterized. Part 4 is dedicated to outlining the basic botanical-ecological-chemical characteristic of Houttuynia cordata (chameleon plant). The raw material sourced from this species – Houttuyniae herba, has long been known and used not only in traditional Chinese medicine (TCM) but also in traditional Japanese, Thai and Nepalese medicine. Most attention was devoted to reviewing the professional pharmacological studies of extracts of this raw material. This review documents very important lines of action of the raw material, namely its antioxidant, anticancer and anti-inflammatory properties. In addition, the article highlights the significance of this species as a food product in some Asian countries and as a source of cosmetic raw materials. The aim of the article is to popularize basic knowledge on this new pharmacopoeial species among pharmacists and medical doctors.

Wstęp
W jednym z najnowszych europejskich i polskich dokumentów farmakopealnych – w Suplemencie 9.4 do Farmakopei Europejskiej (1) i w jego tłumaczeniu wraz z Suplementami 9.3 i 9.5 na język polski – w Suplemencie 2018 do XI wydania Farmakopei Polskiej (2) figuruje kilka nowych surowców roślinnych dotychczas niewykorzystywanych w oficjalnym lecznictwie w Europie.
W częściach 1 i 2 serii artykułów przedstawiono charakterystykę botaniczno-ekologiczno-chemiczną i walory lecznicze gatunków roślin dostarczających nowych surowców saponinowych: Bupleurum sp. – przewiercień oraz Platycodon grandiflorus – rozwar wielkokwiatowy (3, 4). W części 3 scharakteryzowano Ligusticum chuanxiong – podagrycznik chiński, będący źródłem nowego surowca olejkowego (5). Wymienione gatunki roślin od dawna są znane i wykorzystywane z powodzeniem w tradycyjnej medycynie dalekowschodniej, głównie w tradycyjnej medycynie chińskiej (TCM).
W części 4 serii artykułów zdecydowano się scharakteryzować pstrolistkę sercowatą (Houttuynia cordata), gatunek dostarczający nowego surowca flawonoidowego – Houttuyniae herba (ziele pstrolistki). Charakterystyką objęto aspekty botaniczno-ekologiczne, aktualny stan wiedzy na temat składu chemicznego tego gatunku oraz badań farmakologicznych.
Możliwe zastosowania lecznicze surowca potwierdzone badaniami naukowymi porównano ze wskazaniami TCM, tradycyjnej medycyny japońskiej Kampo, tajlandzkiej i nepalskiej. Celem części 4 jest popularyzacja podstawowej wiedzy dotyczącej Houttuynia cordata – pstrolistki sercowatej w środowisku farmaceutyczno-medycznym.
Pstrolistka sercowata (Houttuynia cordata) – informacje ogólne
Houttuynia cordata Thunb. – pstrolistka sercowata – jest rośliną zielną należącą do rodziny Saururaceae (Jaszczurzowate, Wątlikłoskowate). Jako jedyny reprezentant rodzaju Houttuynia ma kilka nazw synonimowych: Houttuynia emeiensis Z.Y. Zhu & S.L. Zhang, H. foetida Loudon, Polypara cordata Kuntze, P. cochinchinensis Loureiro (6, 7). Gatunek ten w nomenklaturze obcojęzycznej znany jest jako: heart-leaved houttuynia, chameleon, rainbow plant, Bishop’s weed, fish plant (ang.), Yu-Xing-Cao, Ji-Cai, (chin.), dokudame (jap.), E-Sung-Cho (kor.), Khao-tong, Plu-khao (thai.), gi?pcá, di?pcá (viet.) (8-10).
Na obszarze swojego naturalnego występowania – w Azji Południowo-Wschodniej – Houttuynia cordata jest stosowana w lecznictwie tradycyjnym. Ziele (herba) używane jest zarówno w tradycyjnej medycynie w Chinach, jak i w Japonii. W TCM ziele jest stosowane w leczeniu zakażeń dróg oddechowych, zapaleniu dróg moczowych oraz stanach zapalnych skóry i owrzodzeniach, natomiast w tradycyjnej medycynie japońskiej Kampo głównie jako surowiec diuretyczny (11, 12). H. cordata jest też uprawiana do celów kulinarnych i jako okrywowa roślina ozdobna. Gatunek ten został po raz pierwszy opisany przez szwedzkiego przyrodnika Thunberga w 1784 roku w dziele „Flora Japonica”. Istnieją dwa różne chemotypy tego gatunku: typ chiński o zapachu przypominającym kolendrę i typ japoński o zapachu pomarańczowym (12).
Houttuyniae herba (ziele pstrolistki) jest surowcem flawonoidowym. Według Suplementu 9.4 do Farmakopei Europejskiej i Suplementu 2018 do XI wydania Farmakopei Polskiej surowcem są całe lub połamane, wysuszone, kwitnące części nadziemne Houttuynia cordata Thunb. Surowiec standaryzowany wymaga minimum 0,1% kwercytryny (1, 2).
We współczesnych dokumentach farmakopealnych krajów wschodnio-azjatyckich monografia Houttuyniae herba figuruje zarówno w Farmakopei Chińskiej (11), jak i w Farmakopei Japońskiej (13). W 2003 roku ziele pstrolistki zostało zatwierdzone przez Państwową Administrację Medycyny Tradycyjnej Chińskiej Republiki Ludowej jako jeden ze składników w chińskiej mieszance ziołowej do zapobiegania ciężkiemu ostremu zespołowi oddechowemu (ang. severe acute respiratory syndrome – SARS) (14).
Charakterystyka botaniczno-ekologiczna
Houttuynia cordata jest rośliną zielną osiągającą od 30 do 60 cm wysokości. Wytwarza cienkie, płożące kłącza, szeroko rozrastające się w glebie. Łodyga tego gatunku jest zielona, czasami fioletowoczerwona, gładka lub owłosiona na węzłach. U podstawy pokłada się na ziemi, natomiast wyższe partie łodygi są wzniesione. Ulistnienie jest skrętoległe. Liście są zwykle sercowate lub jajowato-sercowate, pod spodem fioletowe, o długości 4-10 cm i szerokości 2,5-6,0 cm. Ogonek liściowy długości do 4 cm obejmuje łodygę. Unerwienie blaszki liściowej stanowi 5-7 nerwów głównych oraz siatka drobnych nerwów bocznych. Kwiaty są drobne, zebrane w gęste kłosy o długości do 2,5 cm z białymi podsadkami. Pręciki zwykle występują w liczbie 3, czasem 4 i są dłuższe od słupka. Zalążnia słupka jest jednokomorowa, zrosła z 3 owocolistków. Gatunek ten kwitnie od kwietnia do września, a owocuje od czerwca do października (7, 12).
H. cordata rośnie na stanowiskach naturalnych w Azji Południowo-Wschodniej – w Chinach, Japonii, Bangladeszu, Kambodży, Korei, Wietnamie, Tajlandii, w niektórych stanach Indii i na Tajwanie. Występuje także w Himalajach do wysokości 2400 m n.p.m. Pstrolistka rośnie na obszarach lekko zacienionych i wilgotnych, m.in. na podmokłych łąkach, brzegach strumieni, jezior i stawów, w lasach i wąwozach. Gatunek ten charakteryzuje się odpornością na mróz do -15°C. H. cordata występuje także jako gatunek zawleczony w Nowej Zelandii, Stanach Zjednoczonych, Kostaryce, Austrii i Czechach (9, 10, 12).
H. cordata figuruje w światowej bazie gatunków inwazyjnych – Global Invasive Species Database (GISD). Ze względu na szeroko rozbudowany system korzeniowy gatunek ten jest bardzo inwazyjny, co w niektórych krajach uznano za poważny problem (15).
Skład chemiczny
Najważniejszymi związkami aktywnymi Houttuyniae herba są flawonoidy. Pierwszym wyizolowanym z liści oraz łodyg pstrolistki związkiem była kwercytryna. Do dzisiaj zidentyfikowano około 15 związków flawonoidowych występujących w tym gatunku (tab. 1). Dominującymi ilościowo związkami są kwercetyna i jej glikozydy: kwercytryna (kwercetyno-3-O-α-L-ramnozyd) i hyperozyd (kwercetyno-3-O-β-D-galaktozyd) (ryc. 1).
Tab. 1. Główne grupy związków chemicznych występujące w Houttuynia cordata
| Grupa związków, przykłady | Piśmiennictwo |
Flawonoidy:
Aglikony: apigenina, izoramnetyna, kemferol, kwercetyna
Glikozydy: awikularyna, awzelina, florydzyna, hyperozyd, izokwercytryna, kwercytryna, rutozyd | 16, 17, 19-22 |
Kwasy fenolowe:
Kwas chlorogenowy, kwas kawowy, kwas kryptochlorogenowy, kwas neochlorogenowy, kwas protokatechowy, kwas wanilinowy, kwas chinowy | 22-24 |
Inne związki fenolowe:
Houttuynamid A, houttuynozyd A, ferulan metylu | 22-24 |
Alkaloidy izochinolinowe:
Aristolaktam A, aristolaktam B, piperolaktam A, 3,4-dimetoksy-N-metylo aristolaktam, cefaradion B, norcefaridion B, splendidina | 23, 24 |
Olejek eteryczny:
β-Myrcen, houttuynina, dekanal, trans-kariofylen, kwas dekanowy, kamfen, β-pinen, aldehyd laurynowy, octan bornylu, α-pinen, limonen, 4-terpineol, nonanol, linalol | 25, 26 |
Sterole:
Stigmast-4-en-3-on, 3β-hydroksystigmast-5-en-7-on, 5α-stigmastan-3,6-dion, stigmast-4-en-3,6-dion, β-sitosterol, brassikasterol, stigmasterol, spinasterol | 23, 27-29 |
Wyższe kwasy tłuszczowe:
Kwas palmitynowy, kwas stearynowy, kwas oleinowy, kwas linolowy, kwas linolenowy | 27 |
Aminokwasy:
Leucyna, kwas asparaginowy, kwas glutaminowy, alanina, walina, izoleucyna, prolina | 30, 31 |
Inne:
Biopierwiastki – Zn, Cu, Fe, Mg, Mn, K | 30, 31 |
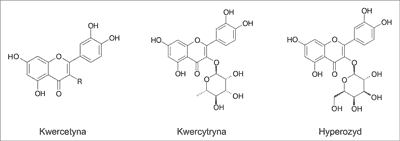
Ryc. 1. Struktura chemiczna głównych flawonoidów charakterystycznych dla ziela pstrolistki
Metodą HPLC określono, które części rośliny są najbogatsze we flawonoidy. Największa ich liczba znajduje się w łodydze i kolejno w owocach, liściach i kwiatach, natomiast w kłączu nie potwierdzono obecności flawonoidów. Przeprowadzono badania, z których wynika, że zawartość trzech głównych związków – kwercetyny, kwercytryny i hyperozydu – różni się w zależności od pochodzenia rośliny, jednak ilość kwercytryny zależy przede wszystkim od organu rośliny, a w mniejszym stopniu od jej pochodzenia (16-21).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. European Pharmacopoeia. 9th ed., Supplement 9.4. Council of Europe. Strasbourg 2017.
2. Farmakopea Polska. Wyd XI. Suplement 2018. Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych. Warszawa 2018.
3. Ekiert H, Sondej A, Klimek-Szczykutowicz M i wsp. Nowe surowce roślinne w Farmakopei Europejskiej. Cz. I. Gatunki rodzaju Bupleurum (przewiercień) – źródło nowego surowca saponinowego. Post Fitoter 2018; 4:248-56.
4. Ekiert H, Sondej A, Klimek-Szczykutowicz M i wsp. Nowe surowce roślinne w Farmakopei Europejskiej. Cz. 2. Rozwar wielkokwiatowy (Platycodon grandiflorus) – źródło nowego surowca saponinowego. Post Fitoter 2019; 1:41-8.
5. Ekiert H, Sondej A, Jafernik K i wsp. Nowe surowce roślinne w Farmakopei Europejskiej. Cz. 3 Ligusticum chuanxiong (podagrycznik chiński) – źródło nowego surowca olejkowego. Post Fitoter 2019; 2:102-10.
6. The Plant List. Houttuynia cordata (Online); http://www.theplantlist.org/tpl1.1/record/kew-2853867.
7. Xia N, Brach AR. Houttuynia. Flora of China 1999; 4:109.
8. U.S. National Plant Germplasm System (Online); https://npgsweb.ars-grin.gov/gringlobal/taxonomydetail.aspx?102694.
9. Plants for a future (Online); http://www.pfaf.org/user/plant.aspx?latinname=Houttuynia+cordata.
10. Fu J, Dai L, Lin Z i wsp. Houttuynia cordata Thunb.: A review of phytochemistry and pharmacology and quality control. Chin Med 2013; 4:101-23.
11. Chinese Pharmacopoeia Commission. Chinese Materia Medica and Prepared Slices of Chinese Crude Drugs. Pharmacopoeia of the People’s Republic of China. 9th ed. China Medical Science Press, Beijing, 2010.
12. Kew science. Plants of the world online (Online); http://powo.science.kew.org/taxon/urn:lsid:ipni.org:names:927252-1.
13. The Japanese Pharmacopoeia. 17th ed., Ministry of Health and Welfare of Japan. Tokyo 2016.
14. State Administration of Traditional Chinese Medicine of the People’s Republic of China website (Online); http://www.satcm.gov.cn/zhuanti/jbfz/20060901/100052.shtml.
15. Global invasive species database GISD. Species profile Houttuynia cordata (Online); http://www.iucngisd.org/gisd/species.php?sc=854#.
16. Fuse JI, Kanamori H, Sakamoto I i wsp. Flavonol glycosides in Houttuynia cordata. Nat Med 1994; 48:307-11.
17. Kawamura T, Hisata Y, Okuda K i wsp. Pharmacognostical studies of Houttuyniae Herba. (1) Flavonoid glycosides contents of Houttuynia cordata Thunb. Nat Med 1994; 48:208-12.
18. Wu LS, Si JP, Yuan XQ i wsp. Quantitative variation of flavonoids in Houttuynia cordata from different geographic origins in China. Chin J Nat Med 2009; 7:40-5.
19. Eng QC, Yang ZN, Hu JW i wsp. Determination of contents of seven flavonoids in Houttuynia cordata Thunb. by HPLC. J Jian Nor Univ 2008; 32:645-8, 661.
20. Wu X, Li S, Li A i wsp. Chemical components from herba of Houttuynia cordata Thunb. Chung Yao Tsai 2008; 31:1168-70.
21. Hoang TH, Tran QH, Ha VB i wsp. Study on the flavonoid component extracted from leaves of Houttuynia cordata Thunb. in Vietnam. Tap Chi Duoc Hoc 2002; 9:13-5.
22. Nuengchamnong N, Krittasilp K, Ingkaninan K. Rapid screening and identification of antioxidants in aqueous extracts of Houttuynia cordata using LC-ESI-MS coupled with DPPH assay. Food Chem 2009; 117:750-6.
23. Chou SC. The constituents of the Houttuynia cordata Thunb. National Cheng Kung University, Tainan 2005.
24. Wagner H, Bauer R, Xiao P i wsp. Herba Houttuyniae cordatae. Chinese Drug Monogr Analysis 1997; 1:1-11.
25. Zeng H, Jiang L, Zhang Y. Chemical constituents of volatile oil from Houttuynia cordata Thunb. J Plant Res Envir 2003; 12:50-2.
26. Hao X, Li L, Ding Z i wsp. Analysis of essential oil from Houttuynia cordata in Guizhou. Acta Botan Yunnan 1995; 17:350-2.
27. Bauer R, Proebstle A, Lotter H. Cyclooxygenase inhibitory constituents from Houttuynia cordata. Phytomed 1996; 2:305-8.
28. Zheng H, Dong Z, She J. Modern study of traditional chinese medicine. Xue Yuan Press, Beijing 1998.
29. Jong TT, Jean MY. Constituents of Houttuynia cordata and the crystal structure of vomifoliol. J Chin Chem Soc 1993; 40:399-402.
30. Choe KH, Kwon SJ, Lee KC. Chemical composition of Saururaceae growing in Korea. On fatty acids and amino acids of Houttuynia cordata and Saururus chinensis. Punsok Kwahak 1989; 2:285-92.
31. Mori M, Suzuki K, Tsukahara Y i wsp. Changes in the components of Houttuynia cordata during growth. Sagami Joshi Daigaku Kiyo, Shizenkei 1995; 59B:89-95.
32. Ng LT, Yen FL, Liao CW i wsp. Protective effect of Houttuynia cordata extract on bleomycin-induced pulmonary fibrosis in rats. Am J Chin Med 2007; 35:465-75.
33. Cho EJ, Yokozawa T, Rhyu DY i wsp. The inhibitory effects of 12 medicinal plants and their component compounds on lipid peroxidation. Am J Chin Med 2003; 31:907-17.
34. Chen YY, Liu JF, Chen CM i wsp. A study of the antioxidative and antimutagenic effects of Houttuynia cordata Thunb. using an oxidized frying oil-fed model. J Nutr Sci Vitaminol (Tokyo) 2003; 49:327-33.
35. Kim IS, Kim JH, Kim JS i wsp. The inhibitory effect of Houttuynia cordata extract on stem cell factor-induced HMC-1 cell migration. J Ethnopharmacol 2007; 112:90-5.
36. Taguchi K, Hagiwara Y, Kajiyama K i wsp. Pharmacological studies of Houttuyniae Herba: The antiinflammatory effect of quercitrin. J Pharm Soc Jpn 1993; 113:327-33.
37. Jiang XL, Cui HF. Different therapy for different types of ulcerative colitis in China. World J Gastroenterol 2004; 10:1513-20.
38. Zhang W, Lu S, Pan S i wsp. Extraction of volatile oil from Houttuynia cordata and its anti-biotic and anti-virus activities. Pract Preven Med 2008; 15:312-6.
39. Kwon HD, Cha IH, Lee WK i wsp. Antibacterial activity of volatile flavor components from Houttuynia cordata Thunb. Int J Food Sci Nutr 1996; 1:208-13.
40. Meng J, Zong X, Dong X. Study on pharmacological effects of fresh and dry Houttuynia cordata Thunb. Li Shizhen Med Mat Med Res 2008; 19:1315-6.
41. Kim G, Kim D, Lim J. Biological and antibacterial activities of the natural herb Houttuynia cordata water extract against the intracellular bacterial pathogen Salmonella within the RAW 264.7 macrophage. Biol Pharm Bull 2008; 31:2012-7.
42. Hayashi K, Kamiya M, Hayashi T. Virucidal effects of the steam distillate from Houttuynia cordata and its components on HSV-1, influenza virus, and HIV. Planta Med 1995; 61:237-41.
43. Shimura M, Zhou Y, Asada Y i wsp. Inhibition of vpr-induced cell cycle abnormality by quercetin: A novel strategy for searching compounds targeting vpr. Biochem Biophys Res Commun 1999; 261:308-16.
44. Chiang LC, Chang JS, Chen CC i wsp. Anti-herpes simplex virus activity of Bidens pilosa and Houttuynia cordata. Am J Chin Med 2003; 31:355-62.
45. Yan Y, Chen X, Yang X i wsp. Cooperative anti-influenza virus activities of amantadine, ribavirin and herb Houttuynia. Virol Sin 2002; 17:192-4.
46. Choi HJ, Kim JH, Lee CH i wsp. Antiviral activity of quercetin 7-rhamnoside against porcine epidemic diarrhea virus. Antiviral Res 2009; 81:77-81.
47. Zheng X, Tang X, Su X. Experimental study of inhibitory effect of the four traditional chinese herb medicines on epidemic hemorrhagic fever virus. Hunan I Ko Ta Hsueh Hsueh Pao 1993; 18:165-7.
48. Kwon KB, Kim EK, Shin BC i wsp. Herba Houttuyniae extract induces apoptotic death of human promyelocytic leukemia cells via caspase activation accompanied by dissipation of mitochondrial membrane potential and cytochrome c release. Exp Mol Med 2003; 35:91-7.
49. Kim SK, Ryu SY, No J i wsp. Cytotoxic alkaloids from Houttuynia cordata. Arch Pharm Res 2001; 24:518-21.
50. Wang H, Lu F, Xiu Y. Effect of Houttuynia cordata on urinary albumin and insulin resistance of diabetes mellitus rats. Trad Chin Drug Clinic Pharmacol 2008; 19:12-4.
51. Wang F, Lu F, Chen G i wsp. Effects of Houttuynia cordata Thunb. on expression of BMP-7 and TGF-beta1 in the renal tissues of diabetic rats. J Trad Chin Med 2007; 27:220-5.
52. Shim SY, Seo YK, Park JR. Down-regulation of Fc?RI expression by Houttuynia cordata Thunb. extract in human basophilic KU812F cells. J Med Food 2009; 12:383-8.
53. Park JC, Hur JM, Park JG i wsp. The effects of Houttuynia cordata on the hepatic bromobenzene metabolizing enzyme system in rats and isolation of phenolic compounds. Kor J Pharmacogn 2000; 31:228-34.
54. Nakamura H, Ota T, Fukuchi G. The constituents of diu-retic drugs. II. The flavonol glucoside of Houttuynia cordata Thunb. J Pharm Soc Jpn 1936; 56:68.
55. Kimura Y, Nishikawa Y. Standardization of crude drugs. III. 2. Component of Houttuynia cordata. J Pharm Soc Jpn 1953; 73:196-8.
56. Ohta T. The diuretic components of Houttuynia cordata. J Pharm Soc Jpn 1942; 62:105-6.
57. Cosmetic Ingredient Database (Online); https://ec.europa.eu.

