© Borgis - Anestezjologia Intensywna Terapia 3/2002, s. 187-193
Krzysztof Kusza1, Maciej Błaszyk1, Maria Siemionow2, K.C. Wong3
Zmiany w hemodynamice mikrokrążenia wolnego płata mięśniowego podczas dożylnego wlewu propofolu
Alteration in peripheral microcirculatory haemodynamics of muscle flaps during propofol infusion anaesthesia
1 Zakład Anestezjologii Klinicznej; Katedry Anestezjologii i Intensywnej Terapii kierownik: prof. dr hab. W. Jurczyk – AM w Poznaniu
2Department of Plastic and Reconstrucive Surgery, Cleveland Clinic Foundation, Cleveland, OH , USA
3Department of Anesthesiology, University of Utah, Salt Lake City, UT, USA
Streszczenie
Propofol jest lekiem powszechnie stosowanym w praktyce anestezjologicznej oraz w oddziałach intensywnej terapii. Podczas jego infuzji dochodzi do spadku proliferacji limfocytów, a także do hiperlipidemii, hipertrójglicerydemii, zaburzeń neurologicznych i kwasicy metabolicznej. Mechanizm powstawania tych powikłań nie jest dokładnie poznany. Celem badania było poznanie wpływu dożylnej infuzji propofolu na hemodynamikę mikrokrążenia w wolnym płacie mięśniowym mięśnia dźwigacza jądra szczura, z wykorzystaniem mikroskopii przyżyciowej. Badaniom poddano osiem szczurów rasy Sprague-Dawley usypianych dootrzewnowo pentobarbitalem (40 mg kg-1). Po zaintubowaniu szczury wentylowano mieszaniną tlenu z powietrzem (FiO2 0,35), utrzymując PaCO2 na poziomie 39±4 mmHg (5,2-5,77 kPa). Propofol podawano przez żyłę udową we wlewie w dawce 2,5 mg-1 kg-1 godz-1. Monitorowano MAP, CVP, EKG, pH, PaCO2 i PaO2. Izolowano mięsień dźwigacz jądra jako wolny płat mięśniowy, w którym dokonywano pomiarów średnicy tętniczek A1, A2 i A3, prędkości przepływu krwinek czerwonych w tych tętniczkach i żyłce zawłośniczkowej, liczono ilość toczących się leukocytów i limfocytów, ilość przylegających do śródbłonka leukocytów i limfocytów, ilość znajdujących się poza światłem żyłki leukocytów i limfocytów, oraz obliczano wskaźnik obrzęku śródbłonka i liczbę naczyń włosowatych z zachowanym przepływem krwi. W ostatnich trzech godzinach podawania propofolu znamiennie obniżyła się średnica naczyń A1 i A2 (16,2% i 12,3%, p<0,05) Średnia liczba toczących się leukocytów i limfocytów znamiennie zmniejszyły się (odpowiednio o 49,1% i 53,5%) ale liczba przylegających do ściany naczynia leukocytów zwiększyła się o 41,6% w stosunku do wartości z pierwszej godziny obserwacji (p<0,05). Temu zjawisku towarzyszył 54,9% wzrost liczby przechodzących przez ścianę naczynia leukocytów (p<0,05). Wskaźnik obrzęku śródbłonka wzrósł o 8,4% przy porównaniu wartości z pierwszej i czwartej godzinie obserwacji (p<0,05). Liczba naczyń włosowatych z czynnym przepływem malała w trakcie doświadczenia i była średnio o 25,4% niższa od ilości czynnych włośniczek policzonej w pierwszej godzinie obserwacji (p<0,05). Infuzja propofolu spowodowała istotne zmiany w zachowaniu się leukocytów wyrażone przez spadek ich całkowitej liczby w obszarze wolnego płata mięśniowego oraz poprzez zwiększenie ich możliwości adhezyjnych. Niespodziewany spadek liczby limfocytów może sugerować immunomodulujący efekt propofolu, który powinien być rozważony w przypadku zastosowania tego leku u chorych z zaburzeniami w układzie odpornościowym lub narażonych na ciężki uraz.
Summary
Propofol intravenous anesthesia is widely used in intensive care patients and in cardiovascular surgery, neurosurgery, ambulatory surgery, transplantology and reconstructive surgery. It was found to reduce proliferative response of lymphocytes in intensive care patients and cause hyperlipidemia, hypertriglycerinemia, neurological sequelae and metabolic acidosis. The mechanism of these adverse effects is unknown. The aim of the study was to investigate, using intravital microscopy, the effect of propofol on muscle flap haemodynamics, RBC velocities, vessel diameters leukocyte, lymphocyte activation and capillary perfusion in the cremaster muscle flap in vivo experimental model. Eight Sprague-Dawley rats were studied in one experimental group (n=8). Following 40 mg kg-1 pentobarbital intraperitoneal induction, trachea was intubated and lungs were ventilated with FiO2 = 0.35 to maintain PaCO2 at 5.2 – 5.67 kPa. Propofol was infused at 2.5 mg kg-1 h-1 via femoral vein. MAP, CVP, ECG, pH, PaCO2, PaO2 were monitored. Next, the cremaster muscle flap was isolated on neurovascular pedicle, and prepared for 4 hours of intravital microscopic measurements of vessel diameters, RBC velocities, leukocyte and lymphocyte activation (rollers, stickers and transmigrating WBC), endothelial edema index, and capillary perfusion. The arteriolar diameters A-1 (19.3%) and A-2 (12.1%) significantly decreased in last three hours of observation (p<0.05). The average number of rolling leukocytes (50.5%) and rolling lymphocytes (55.4%) significantly decreased, but the number of sticking leukocytes increased by 41.4% (p<0.05) when the first and the last hour of observation were compared. This was accompanied by the 78.2% increases in transmigrating leukocytes (p<0.05). Endothelial edema index increased by 18% in last hour of observation, compared to the first hour of observation (p<0.05). The number of flowing capillaries significantly decreased trough the observation time, and in the last hour of observation capillary density was 34.1% less, compared with the first hour of observation (p<0,05). We conclude that propofol anaesthesia significantly alters leukocyte function by decreasing the total number of PMNs and the adhesive properties of the leukocyte. The unexpected decrease of lymphocytic activation may further suggest immunomodulary effect of this agent and should be considered when propofol is used in immunocompromised patients and patients exposed to severe trauma.

Propofol jest anestetykiem stosowanym w anestezji całkowicie dożylnej podczas operacji kardiochirurgicznych, neurochirurgicznych, przeszczepiania tkanek i narządów oraz wielu innych. Środek ten ma również zastosowanie w wielodobowej sedacji u chorych leczonych w oddziałach intensywnej terapii [1, 2].
Dowiedziono, że propofol odpowiada za spadek proliferacji limfocytów u pacjentów leczonych w oddziałach intensywnej terapii, jak również, że za jego przyczyną dochodzi do hiperlipidemii, hipertrójglicerydemii, zaburzeń o charakterze neurologicznym oraz do kwasicy metabolicznej [3, 4]. Jest to szczególnie istotne, ponieważ mechanizmy reakcji immunologicznych są zaburzane podczas anestezji, szczególnie u chorych po ciężkich urazach [5, 6].
Wpływ propofolu na układ sercowo-naczyniowy zostały dobrze udokumentowane, chociaż ciągle budzą kontrowersje. W badaniach na zwierzętach dowiedziono, że wpływ propofolu na wielkość systemowego oporu naczyniowego, częstość akcji serca i rzut serca jest zależny od dawki i sposobu podawania. Udowodniono bezpośredni wpływ propofolu na rozszerzenie żylnego łożyska naczyniowego i zmiany w dystrybucji krwi na poziomie mikrokrążenia [7, 8, 9, 10]. Nadal jednak nie są znane wszystkie bezpośrednie przyczyny tych zjawisk i brak jest doniesień, które w sposób ilościowy i jakościowy przedstawiałyby wpływ propofolu na wszystkie dostępne w badaniu in vivo elementy strukturalne i morfotyczne krwi wchodzące w skład mikrokrążenia.
Celem pracy jest prześledzenie wpływu dożylnego wlewu propofolu na hemodynamikę mikrokrążenia obwodowego w wolnym płacie mięśniowym szczura przy użyciu specjalnego systemu mikroskopii świetlnej do obserwacji mikrokrążenia w warunkach przyżyciowych. Analiza zachowania się wszystkich podlegających obiektywnej ocenie składowych mikrokrążenia obwodowego w mięśniu szkieletowym podczas wlewu propofolu, przeprowadzona w czasie rzeczywistym, w warunkach obserwacji in vivo z użyciem przedstawionych poniżej technik nie była dotychczas prezentowana.
MATERIAŁ I METODA
Protokół doświadczenia został zaakceptowany przez Komisję Opieki Nad Zwierzętami Doświadczalnymi Uniwersytetu Stanowego Utah w Salt Lake City. Osiem szczurów płci męskiej rasy Sprague-Dawley, ważących średnio 147g, poddano badaniu w jednej grupie doświadczalnej. Zwierzęta usypiano dootrzewnowo pentobarbitalem (Abbott, USA) w dawce 40 mg kg-1, a następnie intubowano cewnikiem dożylnym 16 G. Płuca wentylowano stosując respirator dla małych zwierząt (141 NEMI Scientific, Medway, MA), używając mieszaniny tlenu z powietrzem przy FiO2 = 0,35 i częstości 90-100/min przy objętości oddechowej (TV) 0,8-0,9 ml 100 g mc-1, w taki sposób aby prężność CO2 we krwi tętniczej utrzymywała się w granicach 39 – 43 mmHg (5,2 – 5,73 kPa). Zapis EKG z odprowadzenia II rejestrowano przy pomocy elektrod igłowych. Ciepłotę ciała mierzono przy użyciu mikrosondy założonej do przełyku i utrzymywano na poziomie 37oC, dzięki zastosowaniu lampy grzewczej.
Wypreparowywano i kaniulowano cewnikami 26G przy użyciu mikroskopu operacyjnego Zeiss OPMi6 (Zeiss Corp. Germany) lewą tętnicę udową, lewą żyłę udową, lewą żyłę szyjną i prawą tętnicę szyjną wspólną. Lewą tętnicę udową i lewą żyłę udową kaniulowano celem pomiaru MAP i uzupełniania niedoboru wody i elektrolitów (roztworem 0,9% NaCl w objętości 0,8 ml 100 g-1 h-1). Ośrodkowe ciśnienie żylne (CVP) mierzono w lewej żyle szyjnej, a z prawej tętnicy szyjnej wspólnej pobierano krew do badań gazometrycznych. Do prawej żyły udowej podawano propofol w dawce 2,5 mg kg-1h-1 przez 4 godziny. Obserwację krzywych ciśnień i zapisu EKG prowadzono przy użyciu monitora Hewlett Packard 78353A, a zapisywano na wielokanałowym rejestratorze firmy Gould Recorder 2800S. Schemat monitorowania czynności życiowych przedstawiono na ryc. 1.

Ryc. 1. Schemat monitorowania czynności życiowych
Mięsień dźwigacz jądra izolowano od pęczka nerwowo-naczyniowego jako wolny płat mięśniowy według metody Siemionow. Podczas tego zabiegu chirurgicznego nerw płciowo-udowy, odpowiadający także za unerwienie autonomiczne mięśnia dźwigacza jądra, koagulowano najpierw na odcinku jednego centymetra a następnie przecinano, co powodowało całkowite odnerwienie poddanego obserwacji mięśnia [11].
Badań i obserwacji dokonywano przy użyciu mikroskopu Nikon Optiphot-2 wyposażonego w normalne soczewki. Mikroskop został połączony z kamerą video (Hitachi KP-C503) i równocześnie sprzężony z dopplerowskim miernikiem prędkości przepływu dla krwinek czerwonych (Texas A&M Instruments) oraz z procesorem pomiaru prędkości przepływu. Uzyskany obraz mikrokrążenia był wyświetlany na monitorze telewizyjnym, gdzie końcowe powiększenie uzyskanego obrazu mikroskopowego wynosiło 1800x. Metodę uprzednio szczegółowo opisano przez autorów tej pracy [12] i przedstawiono na ryc. 2.
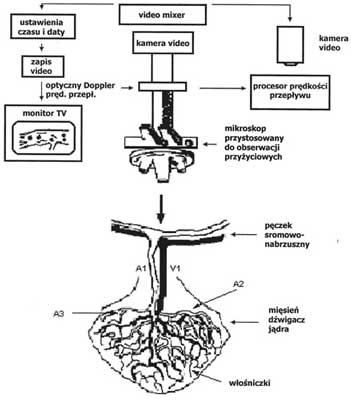
Ryc. 2. Metoda przyżyciowej obserwacji mikrokrążenia w mięśniu dźwigaczu jądra szczura
Na poziomie mikrokrążenia dokonywano obiektywnych pomiarów, w czasie rzeczywistym, następujących parametrów:
1. Średnic tętniczek A1, A2-1, A2-2, A3 i żyłki V1.
2. Prędkości przepływu krwinek czerwonych (RBC velocities) w tętniczkach A1, A2-1, A2-2, A3 oraz w żyłce V1.
3. Zachowania się leukocytów i limfocytów w żyłce zawłośniczkowej. Liczono ilość toczących się przez światło żyłki zawłośniczkowej leukocytów i limfocytów, ilość przyległych do śródbłonka naczynia tych elementów morfotycznych oraz liczbę leukocytów i limfocytów znajdujących się poza światłem żyłki zawłośniczkowej.
4. Wskaźnika obrzęku śródbłonka w żyłce zawłośniczkowej (jest to stosunek wartości średnicy wewnętrznej naczynia do jego średnicy zewnętrznej).
5. Liczby poddanych przepływowi krwi naczyń włosowatych w ściśle wyselekcjonowanym obszarze mięśnia dźwigacza jądra. Pomiaru tego dokonywano w 27 polach tego mięśnia.
Wszystkich pomiarów dokonywano w czasie czterech godzin, powtarzając je zawsze w tych samych miejscach badanego mięśnia co godzinę. Ilość toczących się przez światło żyłki zawłośniczkowej leukocytów i limfocytów mierzona była przez 2 minuty, co godzinę, przy użyciu licznika ręcznego.
Szczegółowa charakterystyka parametrów mierzonych na poziomie mikrokrążenia została podana we wcześniejszych publikacjach [13, 14].
Analizy statystycznej otrzymanych wyników dokonano przy użyciu testu analizy wariancji (one-way Annova repeated measures). Statystyczna znamienność była wyznaczona przez wartość p<0,05.
WYNIKI
Podczas doświadczenia wartość MAP utrzymywała się na stałym poziomie, chociaż w ostatniej godzinie obserwacji obniżyła się o 12,3% w stosunku do wielkości zanotowanej w pierwszej godzinie obserwacji i była to różnica znamienna (p<0,05). CVP utrzymywało się w granicach porównywalnych wartości w ostatnich trzech godzinach obserwacji, jednak na poziomie wyższym o 66,7% od wartości z pierwszej godziny. Analiza gazometryczna krwi wykazała brak zaburzeń w wymianie gazowej i stabilną wartość odczynu krwi tętniczej w całym czterogodzinnym przedziale czasowym. Średnie wartości parametrów życiowych ilustruje tabela I.
Tab. I. Średnie wartości parametrów życiowych mierzonych podczas wlewu propofolu
| Parametr | Czas pomiaru | | | |
| 1 godzina | 2 godzina | 3 godzina | 4 godzina |
| HR (bpm) | 283,375 ?22,29 | 292,500 ?10,556* | 295,000 ?7,251* | 295,875 ?5,987* |
| MAP (mm Hg/kPa) | 92,750 ?15,04 | 81,375 ?6,255* | 86,125 ?12,881 | 81,375 ?9,531* |
| /12,364 ?2,005 | /10,8475 ?0,834* | /11,480 ?1,717 | /10,847 ?1,270* |
| CVP (mm Hg/kPa) | 0,750 ?0,886 | 1,375 ?0,916* | 1,125 ?0,641 | 1,250 ?0,463* |
| /0,099 ?0,118 | /0,1835 ?0,122* | /0,149 ?0,085 | /0,167 ?0,0617* |
| pH | 7,402 ?0,04 | brak pomiaru | 7,351 ?0,047 | 7,365 ?0,032 |
| PaO2 (mm Hg/kPa) | 178,025 ?45,694 | brak pomiaru | 166,150 ?32,674 | 152,775 ?44,357 |
| /23,731 ?6,0910 | | /22,147 ?4,355 | /20,365 ?5,913 |
| PaCO2 (mm Hg/kPa) | 31,013 ?3,549 | brak pomiaru | 34,612 ?3,356 | 34,288 ?4,453 |
| /4,134 ?0,473 | | /4,613 ?0,447 | /4,571 ?0,594 |
| Hb (g dl-1) | 12,075 ?1,747 | brak pomiaru | 10,863 ?1,618* | 9,812 ?1,898* |
| Ht (%) | 35,0 ?4,106 | brak pomiaru | 30,625 ?1,685* | 27,375 ?1,598* |
* - p<0,05
Obserwowano wzrost prędkości przepływu krwinek czerwonych we wszystkich badanych tętniczkach. Wzrost ten miał charakter łagodny, postępował z każdą godziną obserwacji i nie był statystycznie znamienny. Średnica tętniczki A1 zmniejszyła się o 16,2%, a tętniczki A2 o 12,3% (p<0,05), jeśli porównać wartości średnic z pierwszej godziny obserwacji do tych zmierzonych w ostatniej godzinie – ryc. 3 i 4. Średnia liczba przepływających przez światło żyłki zawłośniczkowej leukocytów uległa zmniejszeniu o 49,1%, natomiast limfocytów o 53,5% (p<0,05), jeśli porównać wartości z pierwszej godziny obserwacji z wartościami z czwartej godziny – ryc. 5 i 6. Liczba leukocytów przylegających do śródbłonka żyłki zawłośniczkowej wzrosła o 41,6% (p<0,05) w ostatniej godzinie pomiaru w porównaniu z pierwszą godziną doświadczenia – ryc. 7. Istotnie wzrosła liczba leukocytów przechodzących przez śródbłonek żyłki zawłośniczkowej do przestrzeni pozanaczyniowej i średnio była wyższa o 54,9% od obserwowanej w pierwszej godzinie wlewu propofolu (p<0,05). Wskaźnik obrzęku śródbłonka zmierzony w ostatniej godzinie doświadczenia uległ zwiększeniu o 8,4% (p<0,05) w stosunku do wartości pochodzącej z pierwszej godziny obserwacji (ryc. 8). Liczba podlegających przepływowi krwi naczyń włosowatych ulegała sukcesywnemu zmniejszeniu wraz z upływem czasu. W ostatniej godzinie obserwacji liczba czynnych włośniczek była średnio o 24,5% (p<0,05) niższa od liczby czynnych włośniczek policzonej w pierwszej godzinie obserwacji (ryc. 9).
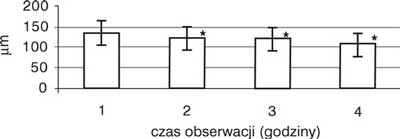
Ryc. 3. Zmiany wartości średnic tętniczek A1 (wartości średnie).
* - p<0,05

Ryc. 4. Zmiany wartości średnic tętniczek A2 (wartości średnie).
* - p<0,05
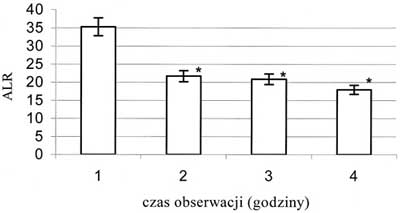
Ryc. 5. Zmiany wartości średniej liczby leukocytów przepływających przez światło żyłki zawłośniczkowej; * - p<0,05; ALR - średnia liczba przepływających leukocytów
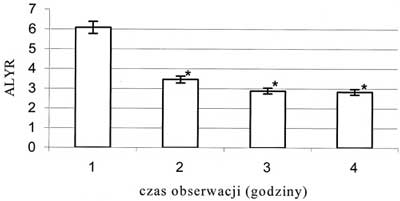
Ryc. 6. Zmiany średniej liczby limfocytów przepływających przez światło żyłki zawłośniczkowej; * - p<0,05; ALYR - średnia liczba przepływających limfocytów
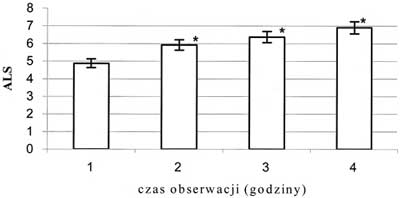
Ryc. 7. Zmiany średniej liczby leukocytów przylegających do śródbłonka w żyłce zawłośniczkowej; * - p<0,05; ALS - średnia liczba przylegających leukocytów
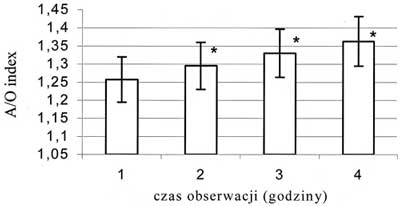
Ryc. 8. Zmiany wskaźnika obrzęku śródbłonka, kalkulowanego z wartości średnich, zewnętrznego i wewnętrznego wymiaru światła żyłki zawłośniczkowej; * - p<0,05; A/O index - wskaźnik obrzęku śródbłonka
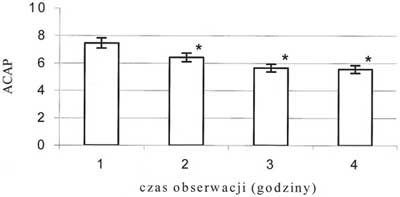
Ryc. 9. Zmiany średniej liczby naczyń włosowatych z czynnym przepływem krwi, ocenianych w 27 polach; * - p<0,05; ACAP - Średnia liczba czynnych włośniczek / 27 pól.
Średnie wartości wszystkich parametrów mierzonych na poziomie mikrokrążenia w mięśniu dźwigaczu jądra podano w tabeli II.
Tab. II. Średnie wartości parametrów mierzonych na poziomie mikrokrążenia podczas wlewu propofolu
| Czas pomiaru | | | |
| Parametr | 1 godzina | 2 godzina | 3 godzina | 4 godzina |
| VA1 | 52,013 ?8,125 | 51,062 ?6,644 | 54,075 ?6,597 | 54,400 ?8,389 |
| VV1 | 19,837 ?8,296 | 18,050 ?9,296 | 17,587 ?8,41 | 15,625 ?6,53* |
| VA2-1 | 33,062 ?8,38 | 34,175 ?5,47 | 34,400 ?8,062 | 35,038 ?10,743 |
| VA2-2 | 40,375 ?4,02 | 39,225 ?5,421 | 41,325 ?9,694 | 45,388 ?12,644 |
| VA3 | 25,513 ?7,98 | 25,150 ?6,629 | 24,337 ?8,182 | 27,163 ?6,773 |
| DV1 | 242,5 ?21,213 | 236,25 ?17,678 | 237,5 ?19,821 | 233,75 ?17,68* |
| DA1 | 135,000 ?19,272 | 124,375 ?23,82* | 123,750 ?26,693* | 113,125 ?24,339* |
| DA2-1 | 81,250 ?16,421 | 78,125 ?18,886 | 73,750 ?17,061 | 71,250 ?19,594* |
| DA2-2 | 101,25 ?9,91 | 101,25 ?8,345 | 99,375 ?10,836 | 90,00 ?12,817* |
| DA3 | 68,75 ?11,26 | 68,75 ?12,748 | 68,125 ?18,114 | 62,5 ?18,323 |
| ALR | 35,287 ?25,118 | 21,688 ?16,832* | 20,863 ?22,919* | 17,950 ?19,762* |
| ALYR | 6,082 ?3,755 | 3,454 ?1,457* | 2,882 ?1,898* | 2,827 ?1,261* |
| ALS | 4,875 ?1,92 | 5,920 ?2,16* | 6,374 ?2,35* | 6,904 ?2,014* | |
| ALYS | 0,336+0,575 | 0,501+0,515 | 0,336+0,575 | 0,373+0,451 |
| OUTLET | 1,456 ?0,908 | 1,956 ?0,722* | 3,298 ?3,215* | 2,256 ?1,213* |
| AO/I | 1,257 ?0,029 | 1,295 ?0,065* | 1,330 ?0,035* | 1,363 ?0,063* |
| ACAP | 7,457 ?0,68 | 6,421 ?0,535* | 5,654 ?0,808* | 5,562 ?0,863* |
Objaśnienia: VA, VV - prędkości przepływu krwinek czerwonych w tętniczkach, i żyłkach (mm x s-1); DA, DV - średnice tętniczek i żyłek ((m); ALR, ALYR - liczba leukocytów i limfocytów przepływających przez światło żyłki zawłośniczkowej; ALS, ALYS - leukocyty i limfocyty przylegające do światła żyłki zawłośniczkowej; OUTLET - leukocyty i limfocyty znajdujące się poza światłem żyłki zawłośniczkowej; AO/I - wskaźnik obrzęku śródbłonka w żyłce zawłośniczkowej; ACAP - liczba poddanych przepływowi krwi naczyń włosowatych;
* - p<0,05.
OMÓWIENIE
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Jenstrup M, Nielsen K, Fruergard K, Moller A.-M, Wieberg- Jorgensen F: Total i.v. anaesthesia with propofol-alfentanil or propofol- fentanyl. Br J Anaesth 1990; 64: 717-722.
2. Gempeler F, Elston AC, Thompson SP, Park GR: Propofol and intralipid cause creaming of serum from critically ill patients. Anaesthesia 1994; 49: 17-20.
3. Pirtikangas C.-O, Perttila J, Salo M: Propofol emulsion reduces proliferative responses of lymphocytes from intensive care patients. Inten Care Med 1993; 19: 299-302.
4. McLeod G, Dick J, Wallis Ch, Patterson A, Cox Ch, Colvin J: Propofol 2% in critically ill patients: effect on lipids. Crit Care Med 1997; 25: 1976-1981.
5. Waydhas C, Nast-Kolb D, Trupka A, Zettl R, Kick M, Wiesholler J, Schweiberer L, Jochum M: Posttraumatic inflammatory response, secondary operations and late multiple organ failure. J Trauma 1996; 40: 624-631.
6. Cioffi WG, Burleson DG, Pruitt BA: Leukocyte responses to injury. Archiv Surg 1993; 128: 1260-1267.
7. Puttrick RM, Diedericks J, Sear JW, Glen JB, Foex P, Ryder WA: Effect of graded infusion rates of propofol on regional and global left ventricular function in dog. Br J Anaest 1993; 69: 375-381.
8. Goodchild CS, Serrao JM: Cardiovascular effects of propofol in the anaesthetized dog. Br J Anaesth 1989; 63: 87-92.
9. Muzi M, Bersens RA, Kampine JP, Ebert TJ: Venodilatation contributes to propofol-mediated hypotension in human. Anesth Analg 1992; 74: 877-883.
10. Park WK, Lynch III C, Johns RA: Effects of propofol and thiopental in isolated rat aorta and pulmonary artery. Anesthesiology 1992; 77: 956-963.
11. Siemionow M., Andreasen T., Lister G: Microcirculatory response to surgical trauma in composite-tissue transfer. J Reconstr Microsurg 1995; 11: 7-13.
12. Kusza K, Siemionow M, Nalbantoglu U, Hayes J, Wong KC: Microcirculatory response to halothane and isoflurane anesthesia. Ann Plast Surg 1999; 43: 57-66.
13. Nalbantoglu U, Kusza K, Chick L, Siemionow M: Harmful effects of invasive animal monitoring on muscle flap microcirculation. Ann Plast Surg 1996; 37: 367-376.
14. Kusza K, Siemionow M, Nalbantoglu U, Wong KC: Zastosowanie doświadczalnego modelu mikrokrążenia do obserwacji in vivo w anestezjologii. Now Lek 1997; 66: 675-684.
15. Baez S: A method for in line measurement of lumen and wall of microscopic vessels in vivo. Microvas Res 1973; 5: 299-305.
16. Sigurdsson GH, Banic A, Wheatley AM, Mettler D: Effects of halothane and isoflurane anaesthesia on microcirculatory blood flow in musculocutaneous flap. Br J Anaesth 1994; 73: 826-832.
17. Longnecker DE, Harris P: Microcirculatory action of general anesthetics. Federation Proceedings 1980; 39: 1580-1583.
18. Holzmann A, Schmidt H, Gebhardt MM, Martin E: Propofol- induced alteration in the microcirculation of hamster striated muscle. Br J Anaesth 1995; 75: 452-456.
19. Furnas H, Rosen JM: Monitoring in microvascular surgery. Ann Plast Surg 1991; 26: 265-272.
20. Pirttinkangas C.-O, Perttila J, Salo M, Vainio O, Liukko-Sipi S: Propofol infusion anaesthesia and immune response in minor surgery. Anaesthesia 1994; 49: 13-16.









