© Borgis - Anestezjologia Intensywna Terapia 3/2002, s. 203-206
Ewa Kucewicz1, Bronisław Czech2, Bogumił Galar3, Grzegorz Juszczyk1, Sławomir Czaban1, Andrzej Siemiątkowski1
Monitorowanie funkcji układu krążenia przy pomocy echokardiografii przezprzełykowej – przydatność metody
The use of transoesophageal echocardiography for cardiovascular monitoring
1 Klinika Anestezjologii i Intensywnej Terapii;
kierownik: dr n. med. A. Siemiątkowski,
2 Klinika Kardiochirurgii;
kierownik: dr n. med. B. Czech – AM w Białymstoku
3 Oddział Kardiologii;
ordynator: dr n. med. B. Galar – Szpitala MSW w Białymstoku

Od czasu zastosowania cewnika Swan-Ganza w praktyce klinicznej nastąpił istotny postęp w monitorowaniu układu krążenia. Przez dziesięciolecia informacje uzyskiwane za pomocą cewnika wprowadzonego do tętnicy płucnej były niezastąpione w czasie prowadzenia znieczulenia u chorych z dużym ryzykiem operacyjnym jak i w planowaniu leczenia pacjentów hospitalizowanych w oddziałach intensywnej terapii. Podstawowymi zaletami cewnika Swan-Ganza są: łatwość założenia, możliwość stosowania przy łóżku chorego i ciągłość monitorowania parametrów hemodynamicznych. Jest to inwazyjna metoda monitorowania układu krążenia, która niesie ze sobą możliwość wystąpienia mniej lub bardziej poważnych powikłań. Wieloletnie doświadczenia kliniczne dowodzą, że uzyskane za pomocą cewnika informacje o ciśnieniach panujących w prawym przedsionku, prawej komorze, tętnicy płucnej i pośrednio w lewym przedsionku nie zawsze korelują z wypełnieniem tych jam serca. Szczególnie duże rozbieżności pomiędzy wartościami ciśnienia a objętością krwi charakteryzują chorych wentylowanych mechanicznie z zastosowaniem dodatniego ciśnienia w końcowej fazie wydechu, z obniżoną podatnością płuc i serca oraz pacjentów z szybką częstością pracy serca [1].
Od końca lat osiemdziesiątych zaczęły pojawiać się doniesienia o nowej, nieinwazyjnej metodzie monitorowania układu krążenia. Dzisiaj próbuje się upowszechnić echokardiografię przezprzełykową (TEE) jako metodę służącą do oceny funkcji serca w czasie operacji i we wczesnym okresie pooperacyjnym. Współcześnie najczęściej stosowana jest w kardiochirurgii, służy także w rozstrzyganiu problemów terapeutycznych u chorych leczonych w oddziałach intensywnej terapii [1,2,3]. Istotnym ograniczeniem metody jest brak możliwości jej stosowania w ciągłym monitorowaniu stanu hemodynamicznego. Należy wspomnieć także o złej tolerancji sondy u chorych przytomnych, możliwości wystąpienia powikłań u pacjentów z zaburzeniami krzepnięcia krwi, po urazach klatki piersiowej i u chorych, u których nie dysponujemy informacjami o współistniejących i przebytych chorobach. Entuzjazm, jaki wzbudza TEE prowadzi do skrajnych postaw polegających na wygłaszaniu kontrowersyjnych opinii dotyczących diagnostyki pacjentów w ciężkim stanie ogólnym. Zasugerowano, że niewykonanie u tych chorych TEE może być przyczyną niedostatecznego leczenia wynikającego z niepełnej diagnostyki [1]. Być może usprawiedliwieniem dla tego rodzaju poglądów jest fakt, że po wykonaniu badania przezprzełykowego u 44% chorych następowała zmiana dotychczasowej terapii. Wszyscy omawiani pacjenci byli monitorowani przy użyciu cewnika Swan-Ganza. Okazało się także, że u 52% chorych z objawami niestabilności układu krążenia przyczyna tego stanu została wyjaśniona na podstawie TEE [1,2].
Zupełnie zrozumiałe jest śródoperacyjne używanie TEE. W intensywnej terapii ma ono przewagę nad badaniem przezklatkowym, ponieważ nie zawsze można chorego ułożyć na lewym boku, obrazy u chorych wentylowanych mechanicznie bywają nieczytelne, a obecność drenów czy opatrunku na klatce piersiowej uniemożliwia przyłożenie głowicy. Znacznie łatwiej i pewniej można ocenić w badaniu przezprzełykowym funkcję sztucznych zastawek serca, aortę wstępującą i zstępującą, stwierdzić obecność tamponady i wegetacji na zastawkach [2].
Badanie przezprzełykowe wykonywane jest w pewnym, określonym porządku i składa się z kilku typowych projekcji. Najczęściej zaczyna się od poprzecznej projekcji przezżołądkowej, w której ocenie podlega globalna kurczliwość lewej i prawej komory, ich wypełnienie oraz identyfikowane są ewentualne obecne zaburzenia kurczliwości odcinkowej (ryc. 1).
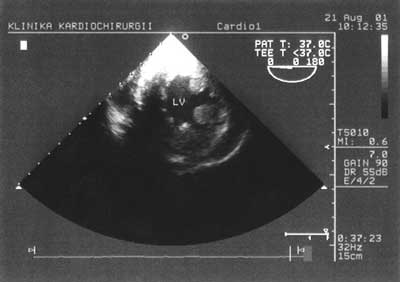
Ryc. 1. Przekrój poprzeczny przez lewą komorę na wysokości mięśni brodawkowatych
Podciągając głowicę kilka centymetrów, pozostawiając ją w dalszym ciągu w żołądku, uzyskujemy obraz zastawki mitralnej, z możliwością podziału płatków przedniego i tylnego na segmenty, co ma zasadnicze znaczenie w sytuacji operacji naprawczej tej zastawki. Następnym etapem badania są projekcje przezprzełykowe. W środkowym odcinku przełyku uzyskujemy obraz czterojamowy, który pozwala na ocenę morfologii i funkcji zastawek mitralnej i trójdzielnej oraz kurczliwości przegrody międzykomorowej i wolnej ściany prawej komory (ryc. 2).
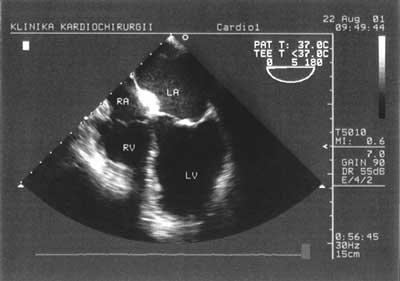
Ryc. 2. Projekcja czterojamowa w przekroju podłużnym
Zastosowanie metody dopplera pulsacyjnego pozwala na zobrazowanie przepływu krwi przez zastawkę mitralną i na tej podstawie ocenę funkcji rozkurczowej lewej komory. Podciągnięcie sondy o kolejne kilka centymetrów umożliwia uzyskanie projekcji pięciojamowej z uwidocznieniem drogi wypływu lewej komory (ryc. 3). Na tej samej wysokości, zmieniając położenie sondy można obejrzeć uszko lewego przedsionka w poszukiwaniu skrzeplin. Podciągnięcie głowicy jeszcze wyżej umożliwia uzyskanie poprzecznej projekcji przez zastawkę aortalną (ryc. 4), a zmiana kąta wiązki fal pozwala uwidocznić aortę wstępującą (ryc. 5). Projekcja w górnym przełyku obrazuje pień tętnicy płucnej i jego rozgałęzienie. W ten sposób w wielkim skrócie wygląda rutynowe, przezprzełykowe badanie echokardiograficzne [2].
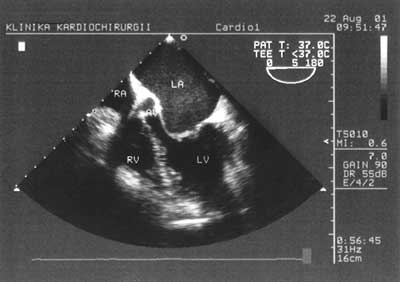
Ryc. 3. Projekcja pięciojamowa w przekroju podłużnym
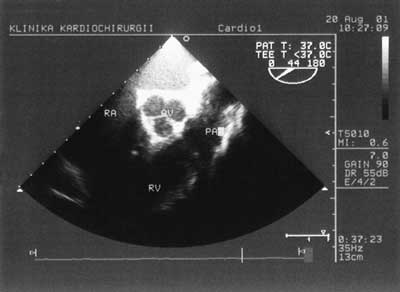
Ryc. 4. Zastawka aortalna w przekroju poprzecznym
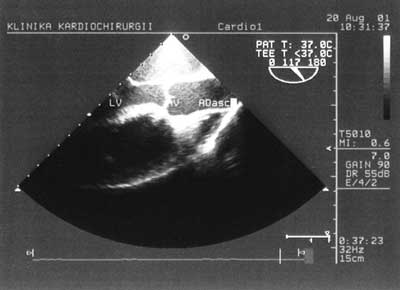
Ryc. 5. Droga wypływu lewej komory i aorta wstępująca w przekroju podłużnym
Udowodniono przydatność badania przezprzełykowego w ocenie hemodynamiki układu krążenia – funkcji serca i stopnia jego wypełnienia. Metoda jest szczególnie przydatna w ocenie wydolności prawej komory, której dysfunkcja powoduje początkowo obniżenie obciążenia wstępnego lewej komory a w konsekwencji spadek ciśnienia systemowego krwi [4].
Analizując odcinkową kurczliwość ścian lewej komory określa się ją jako normokinezę, hipokinezę, akinezę i dyskinezę. Poszczególne segmenty mięśnia są zaopatrywane przez trzy największe tętnice wieńcowe. Projekcja przezżołądkowa poprzeczna pozwala na zidentyfikowanie naczynia, w którym występują zaburzenia przepływu krwi. Część epizodów niedokrwienia mięśnia sercowego nie ma odzwierciedlenia w elektrokardiogramie. Odcinkowe zaburzenia kurczliwości mięśnia są bardziej czułym wskaźnikiem niedokrwienia niż zmiany w odcinku ST EKG. Dotyczy to szczególnie niedokrwienia występującego w tylnym i bocznym kwadrancie lewej komory, gdzie jest rozpoznawane 55% wszystkich udokumentowanych ultrasonograficznie zmian niedokrwiennych. Czułość badania EKG w rozpoznawaniu niedokrwienia rośnie, jeżeli używany jest system 12 odprowadzeń, co nie jest standardem monitorowania w salach operacyjnych [5]. Stosując śródoperacyjnie TEE stwierdzono, że incydenty niedokrwienia mają miejsce we wszystkich etapach operacji kardiochirurgicznych. Przyczyną niepowodzeń w okresie pooperacyjnym (zespół małego rzutu, zawał mięśnia sercowego) są niedokrwienia pojawiające się po zakończeniu krążenia pozaustrojowego. Odcinkowe zaburzenia kurczliwości obserwuje się również pomimo prawidłowej rewaskularyzacji tętnic wieńcowych, co może być wynikiem ostrego (ogłuszenie) lub przewlekłego (zamrożenie) niedokrwienia. Takie zmiany są potencjalnie odwracalne. Wykrycie odcinkowych zaburzeń kurczliwości obliguje anestezjologa do działań zmierzających do poprawy bilansu tlenowego mięśnia sercowego, a chirurga do kontroli drożności zespoleń [5]. Można więc przypisać TEE unikalną zdolność selekcjonowania chorych predysponowanych do powikłań w okresie pooperacyjnym.
Nieprawidłowa ruchomość przegrody międzykomorowej jest częstym zjawiskiem po operacjach serca. Echokardiografii przezprzełykowej zawdzięczamy wyjaśnienie tej powszechnej patologii. Przyczyną nieprawidłowości jest niedostateczna protekcja mięśnia prawej komory w czasie zatrzymania serca i w konsekwencji upośledzenie ruchomości pierścienia zastawki trójdzielnej. Udowodniono, że prawidłowy ruch pierścienia zastawki trójdzielnej ma istotny wpływ na objętość wyrzutową prawej komory. Nieprawidłowy ruch pierścienia nie pozwala na pełny skurcz wolnej ściany prawej komory i zmniejsza objętość wyrzutową. Postawiono tezę, że przesunięcie przegrody na stronę prawej komory pozwala utrzymać prawidłowy jej rzut. Nieprawidłowy ruch przegrody i pierścienia zastawki trójdzielnej u części pacjentów ulega normalizacji, u części pozostaje na zawsze. Zjawisko to wyjaśnia obecność zrostów pomiędzy prawą komorą a ścianą klatki piersiowej, które ograniczają ruchomość komory a występują w pewnym procencie chorych po operacji. Śródoperacyjnie można próbować przywrócić prawidłowy ruch przegrody poprzez istotne zwiększenie wypełnienia łożyska naczyniowego [6].
Echokardiografia przezprzełykowa jest coraz częściej używana do pomiaru rzutu minutowego serca, a wyniki porównywalne ze złotym standardem pomiaru – metodą termodilucji. Echokardiograficznie objętość wyrzutowa lewej komory wyliczana jest na podstawie równania:
SV (ml) = VTI (cm) x CSA (cm2)
gdzie SV = objętość wyrzutowa, VTI = całka prędkości w funkcji czasu (velocity-time integral), reprezentuje ruch krwinek czerwonych w czasie jednego skurczu serca i CSA = pole powierzchni zastawki
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Poelaert JI, Trouerbach J, De Buyzere M, Everaert J, Colardyn FA: Evaluation of transesophageal echocardiography as a diagnostic and therapeutic aid in critical care setting. Chest 1995; 107: 774-779.
2. Poeleart JI, Schmidt C, Colardyn FA: Transesophageal echocardio-graphy in critically ill. Anesthesia 1998; 53: 55-68.
3. Alam M: Transesophageal echocardiography in critical care units: -Henry Ford hospital experience and review of the literature. Prog Cardiovasc Dis 1996; 4: 315-328.
4. Reichert CLA, Visser CA, Koolen JJ, Brink RBA, van Wezel HB, Meyene NG, Dunning AJ: Transesophageal echocardiography in -hypotensive patients after cardiac operations. J Thorac Cardiovasc Surg 1992; 104: 321-326.
5. Leung JM, O, Kelly B, Browner WS, Tubau J, Hollenberg M, Mangano DT: Prognostic importance of postbypass regional wall-motion abnormalities in patients undergoing coronary artery bypass graft surgery. Anesthesiology 1989; 71: 16-25.
6. Wranne B, Pinto FJ, Siegel LC, Miller DC, Schnittger I: Abnormal postoperative interventricular motion: New intraoperative transesophageal echocardiographic evidence supports a novel hypothesis. Am Heart J 1993; 126: 161-167.
7. Muhiudeen IA, Kuecherer HF, Lee E, Cahalan MK, Schiller NB: Intraoperative estimation of cardiac output by transesophageal pulsed doppler echocardiography. Anesthesiology 1991; 74: 9-14.
8. Katz WE, Gasior TA, Quinlan JJ, Gorcsan III J: Transgastric continuous-wave doppler to determine cardiac output. Am J Cardiol 1993; 71: 853-857.
9. Darmon PL, Hillel Z, Mogtader A, Thys DM: A study of the human aortic valve orifice by transesophageal echocardiography. J Am Soc Echocardiogr 1996; 9: 668-674.
10. Feibberg MS, Hopkins WE, Davila-Roman VG, Barzilai B: Multiplane transesophageal echocardiographic doppler imaging accurately determines cardiac output measurements in critically ill patients. Chest 1995; 107: 769-73.
11. Savino JS, Troianos ChA, Aukburg S, Weiss R, Reichek N: Measurement of pulmonary blood flow with transesophageal two-dimensional and doppler echocardiography. Anesthesiology 1991; 75: 445-451.
12. Darmon PL, Hillel Z, Mogtader A, Mindich B, Thys D: Cardiac output by transesophageal echocardiography using continuous-wave doppler across the aortic valve. Anesthesiology 1994; 80: 796-805.
13. Poeleart J, Schmidt C, Van Aken H, Hinder F, Mollhoff T, Loick N: A comparison of transesophageal echocardiographic doppler across the aortic valve and the thermodilution technique for estimating cardiac output. Anesthesia 1999; 54: 128-136.
14. Beapure PN, Cahalan MK, Kremer PF, Roizen MF, Cronnelly R, Robinson S, Lurz FW, Alpert R, Hamilton WK, Schiller NB: Does pulmonary artery occlusion pressure adequately reflect left ventricular filling during anesthesia and surgery? Anesthesiology 1983; 59: A3
15. Cheung AT, Savino JS, Weiss SJ, Aukburg SJ, Berlin JA: Echocardiographic and hemodynamic indexes of left ventricular preload in patients with normal and abnormal ventricular function. Anesthesiology 1994; 81: 376-387.
16. Greim CA, Roewer N, Schilte J: Assessement of changes in left ventricular wall stress from the end-systolic pressure-area product. Br J Anesth 1995; 75: 583-587.
17. Chan K-L, Blakley M, Andrews J, Barrie M: Transesophageal echocardiography for assessing cause of hypotension after cardiac surgery. Am J Cardiol 1988; 62: 15: 1142-1143.





