© Borgis - Anestezjologia Intensywna Terapia 2/2007, s. 80-84
*Wojciech Dąbrowski
Zmiany ciśnienia śródbrzusznego u chorych poddanych chirurgicznej rewaskularyzacji mięśnia sercowego
Effect of extracorporeal circulation on intra-abdominal pressure
Klinika Anestezjologii i Intensywnej Terapii AM w Lublinie
kierownik: prof. dr hab. n. med. A. Nestorowicz
Summary
Background. Increased intra-abdominal pressure (IAP) may play an important role in pathophysiology related to surgery performed under extracorporeal circulation (ECC), especially when intra-abdominal compartment syndrome occurs. Causes of IAP increases are not well defined, and haemodilution may contribute. Changes in IAP were assessed during CABG surgery under extracorporeal circulation.
Methods. The study was conducted in 25 male patients, aged 53-67 years, scheduled for elective CABG surgery. Bladder pressure was measured via a Foley catheter: 1) after induction of anaesthesia; 2) at the start of ECC; 3) after weaning from the ECC; 4) immediately before transportation to the PITU; 5) one hour after surgery; 6) six hours after surgery; and 7) 18 hours after surgery.
Results. The mean duration of anaesthesia was 225.1±26.0 min, and the mean duration of ECC was 96.6±22.7 min. IAP increased at the 3rd, 4th, 5th and 6th measuring points and returned to normal 18 hours after surgery. No complications occurred.
Discussion. The most probable reason for the increased IAP during ECC is normovolaemic haemodilution causing intestinal oedema and capillary leakage. Postoperative crystalloid infusion did not increase IAP.

Gdy w XIX wieku Marley po raz pierwszy określił zależność pomiędzy uniesieniem przepony a ciśnieniem panującym wewnątrz jamy brzusznej (IAP – Intra-Abdominal Pressure) nikt nie przypuszczał, że problem ten stanie się kiedykolwiek istotny klinicznie. To ważne odkrycie pozostało niedocenione, aż do momentu, w którym stwierdzono, że wzrost IAP wywołuje spadek przepływu nerkowego, a jego wartości powyżej 27 cm H2O (2,65 kPa) powodują śmiertelne w skutkach upośledzenie oddychania. Ujawniono też, że wzrost ciśnienia w jamie brzusznej indukuje spadek powrotu żylnego i upośledzenie krążenia wieńcowego. W 1951 r. Baggot [1] opisał przypadek śmierci noworodka, u którego dokonano jednoetapowej operacyjnej korekcji wrodzonego wytrzewienia. Jego zdaniem przyczyną śmierci była ostra niewydolność oddechowa spowodowana uwięźnięciem powietrza w jamie brzusznej. On też po raz pierwszy wprowadził określenie „ostry ciśnieniowy pneumo – peritonit”, zalecając w podobnych przypadkach rezygnację z ciasnego zamykania powłok jamy brzusznej na korzyść otwartego, aseptycznego gojenia się rany.
Powszechnie wiadomo, że panujące w warunkach fizjologicznych IAP waha się w granicach 0-5 mm Hg (0-0,65 kPa) i ściśle zależy od aktywności fizycznej oraz stosunków anatomicznych panujących w jamie brzusznej [2, 3]. Wielu badaczy podkreśla, że niewielki wzrost IAP nie ma znaczenia klinicznego i dopiero powyżej 20 mm Hg (2,6 kPa) ciśnienie to może niekorzystnie wpływać na funkcjonowanie nie tylko narządów jamy brzusznej, ale również na cały organizm [3, 4, 5]. Z tego też powodu wartości IAP przekraczające 20-25 mm Hg (2,6-3,25 kPa) wg de Cleva i wsp. [6] – nazywa się nadciśnieniem śródbrzusznym (IAH – Intra-Abdominal Hypertension), zaś towarzyszące mu zmiany określono nazwą zespołu ciasnoty śródbrzusznej (ACS – Abdominal Compartment Syndrome). Cechą charakterystyczną ACS jest zatem uogólniona niewydolność wielonarządowa, której nasilenie ściśle zależy od wysokości IAP i która ustępuje w przypadkach wczesnej dekompresji jamy brzusznej. Wg de Cleva i wsp. [6] ACS można rozpoznać dopiero wtedy, gdy IAP stosunkowo szybko wzrośnie powyżej 20 mm Hg (2,6 kPa) powodując wzrost szczytowego ciśnienia wdechowego powyżej 45 cm H2O (0,44 kPa), spadek wartości dostarczenia tlenu poniżej 600 ml min-1m-2, ograniczenie diurezy poniżej 0,5 ml kg-1 h-1, a także, wymagającą leczenia aminami katecholowymi niewydolność krążenia.
Trudno nie zauważyć wpływu jaki może mieć podwyższone ciśnienie w jamie otrzewnej na stan kliniczny chorych poddanych skomplikowanym procedurom terapeutycznym. Problem ten wydaje się być szczególnie istotny w przypadkach chorych operowanych z zastosowaniem krążenia pozaustrojowego. Złożony charakter operacji jak również śród- i pooperacyjne leczenie mogą skutkować wzrostem IAP, co z kolei może być przyczyną rozwoju istotnych dla życia powikłań.
Celem pracy była ocena zmian ciśnienia śródbrzusznego u chorych poddanych chirurgicznej rewaskularyzacji mięśnia sercowego w krążeniu pozaustrojowym.
Metodyka
Po uzyskaniu zgody Komisji Bioetyki przy AM w Lublinie (KE-0254/113/2005) oraz świadomej zgody chorych, do badań zakwalifikowano osoby poddane chirurgicznej rewaskularyzacji mięśnia sercowego w krążeniu pozaustrojowym z powodu stabilnej choroby wieńcowej stopnia I, II lub III wg skali CCS ( Canadian Cardiovascular Society).
W przeddzień operacji, wieczorem, badani otrzymali premedykację złożoną z lorazepamu podawanego doustnie w dawce 2 mg oraz prometazyny podawanej domięśniowo w dawce 50 mg. Jedną godzinę przed rozpoczęciem anestezji wszyscy chorzy otrzymywali doustnie 3 mg lorazepamu i domięśniowo 0,1 mg kg-1 morfiny. U wszystkich zastosowano znieczulenie ogólnie z użyciem fentanylu w dawce 0,01-0,02 mg kg-1, midazolamu 0,05-0,1 mg kg-1, oraz etomidatu w dawce 0,1-0,5 mg kg-1, zaś zwiotczenie mięśniowe uzyskiwano przy pomocy pankuronium 0,08-0,1 mg kg-1. Znieczulenie podtrzymywano przy pomocy ciągłej dożylnej infuzji fentanylu i midazolamu oraz frakcjonowanych dawek izofluranu podawanego drogą wziewną w stężeniu 0,5-1%. W trakcie znieczulenia i operacji stosowano sztuczną wentylację płuc w trybie IPPV przy pomocy mieszaniny tlenu i powietrza w stosunku 1:1, pod kontrolą ustalonych parametrów wentylacyjnych. Zakres monitorowania funkcji życiowych stosowany u chorych był typowy dla operacji pomostowania naczyń wieńcowych.
Bezpośrednio po indukcji znieczulenia wszyscy badani otrzymywali wlew 500 ml roztworu żelatyny, który utrzymywano do momentu rozpoczęcia procedury krążenia pozaustrojowego (ECC – ExtraCorporeal Circulation). W trakcie wszczepiania pomostów aortalno-wieńcowych krążenie i wymianę gazową podtrzymywano przy pomocy aparatu płuco–serce S III (Stöckert, USA). Do pierwotnego wypełnienia pompy (priming) zastosowano: roztwór Ringera – 1000 ml, 6% roztwór hydroksyetylowanej skrobi – 500 ml, 20% mannitol 250 ml, wodorowęglan sodowy – 20 ml oraz heparynę w dawce 75 mg. Kardiopleginę przygotowywano na bazie 0,9% roztworu soli kuchennej uzupełnionego 3 g chlorku potasu i 20 ml wodorowęglanu sodowego.
Badania przeprowadzano w siedmiu etapach procedury: 1) po indukcji znieczulenia przed rozpoczęciem operacji, 2) bezpośrednio po rozpoczęciu ECC, 3) po zakończeniu ECC, 4) przed oddaniem chorego do OIOP, 5) 1 h po zakończonej operacji, 6) 6 h po zakończonej operacji oraz 7) rano w pierwszej dobie pooperacyjnej (18 h po operacji).
Pomiaru IAP dokonywano mierząc ciśnienie w pęcherzu moczowym przez zaciśnięty cewnik Foley´a, po uprzednim podaniu 50 ml jałowego 0,9% NaCl.
Uzyskane wyniki poddano obliczeniom statystycznym przy użyciu testu Wilcoxona przyjmując za istotne statystycznie p<0,05.
Wyniki
Badaniami objęto 25 mężczyzn w wieku od 53 do 67 (63,1±4,5) lat o masie ciała 84,48±12,15 kg. Średni czas operacji wynosił 198,4±20,14 min, znieczulenia 225,1±26 min, a krążenia pozaustrojowego 96,6±22,67 min. Aortę zaciskano w sposób typowy, zaś średni czas zamknięcia aorty wynosił 55,36±18,77 min. Wszczepienia pomostów aortalno-wieńcowych dokonywano w normotermii, którą regulowano przy pomocy materaca grzewczego oraz wymiennika ciepła aparatu płuco-serca. Najniższa temperatura podczas procedury krążenia pozaustrojowego wynosiła 34,8±0,38°C. U wszystkich chorych odłączenie od aparatu płuco-serca odbyło się bez powikłań, jak również nie zachodziła konieczność stosowania kontrapulsacji wewnątrzaortalnej. Żaden chory nie wymagał reoperacji oraz pooperacyjnej intensywnej płynoterapii. W bezpośrednim okresie pooperacyjnym badani otrzymali wlew krystaloidów (1550±450 ml) oraz koloidów (500 ml).
Przyjmując wyniki etapu pierwszego za wartości wyjściowe stwierdzono, że procedura krążenia pozaustrojowego wywołała wzrost IAP w 3, 4, 5 oraz 6 etapie badań. W 18 h po zakończonej operacji zanotowano spadek wartości IAP do wartości zarejestrowanych w etapie wyjściowym (ryc. 1, tab. I).
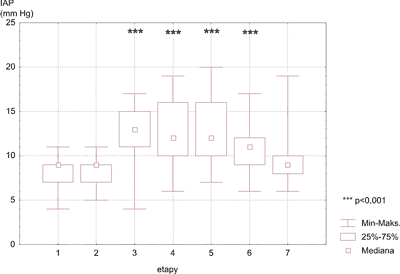
Ryc. 1. Zmiany ciśnienia śródbrzusznego w kolejnych etapach badań.
Tab. I. Analiza statystyczna zmian IAP w poszczególnych etapach badań
| Test kolejności par Wilcoxona (wartości p) |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | etapy |
| - | 0,22502 | 0,000018 | 0,000038 | 0,000087 | 0,000419 | 0,073147 | 1 |
| - | 0,0000163 | 0,000018 | 0,000072 | 0,0005138 | 0,1454096 | 2 |
| | - | 0,236028 | 0,46545 | 0,025391 | 0,002949 | 3 |
| | | - | 0,678668 | 0,00705 | 0,001238 | 4 |
| | | | - | 0,000484 | 0,001675 | 5 |
| | | | | - | 0,004066 | 6 |
| | | | | | - | 7 |
Dyskusja
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Baggot MG: Abdominal blow – out: a concept. Curr Res Anesthesia Analg 1951; 30: 295-256.
2. Bailey J, Shapiro M: Abdominal compartment syndrome. Crit Care 2000; 4: 23-29.
3. Shafik A, El-Sharkawy A, Sharaf WM: Direct measurement of intra-abdominal pressure in varius conditions. Eur J Surg 1997; 163: 883-887.
4. Emerson H: Intra-abdominal pressures. Arch Intern Med 1991; 7: 754-784.
5. Kron IL, Hartman PK, Nolan SP: The measurement of intra-abdominal pressure as a criterion for abdominal re-exploration. Ann Surg 1984; 199: 28-30.
6. De Cleva R, Silva FP, Zilberstein B, Machado DJB: Acute renal failure due to abdominal compartment syndrome: report on four cases and literature review. Rev Hosp Clin Fac Med S Paulo 2001; 56: 123-130.
7. Pleva L, Sir M, Mayzlik J: Abdominal compartment syndrome in polytrauma. Biomed Papers 2004; 148: 81-84.
8. Harman PK, Kron IL, McLachlan HD, Freedlender AE, Nolan SP: Elevated intra-abdominal pressure and renal function. Ann Surg 1982; 196: 594-597.
9. Diebel LN, Dulchawsky SA, Wilson RF: Effects of increased intra-abdominal pressure on mesenteric arterial and intestinal mucosal blood flow. J Trauma 1992; 33: 45-49.
10. Friedlander MH, Simon RJ, Ivatury RR, DiRaimo R, Machiedo GW: Effect of hemorrhage on superior mesenteric artery flow during increased intra-abdominal pressures. J Trauma 1998; 45: 433-439.
11. Ridings PC, Bloomfeld GL, Blocher CR, Sugerman HJ: Cardiopulmonary effects of raised intra-abdominal pressure before and after intravascular volume expansion. J Trauma 1995; 39: 1071-1075.
12. Obeid F, Saba A, Fath J, Gustlis B, Chung R, Sorensen V, Buck J, Horst M: Increased in intra-abdominal pressure affect pulmonary compliance. Arch Surg 1995; 130: 544-548.
13. Sanisoglu I, Guden M, Bayramoglu Z, Saqbas E, Dibekoglu C, Sanisoglu SY, Akpinar B: Does off-pump CABG reduce gastrointestitinal complications? Ann Thorac Surg 2004; 77: 619-625.
14. Morariu AM, Loef BG, Aarts LP, Rietman GW, Rakhorst G, van Oeveren W, Epema AH: Dexamethasone: benefit and prejudice for patients undergoing on-pump coronary artery bypass grafting: a study on myocardial, pulmonary, renal, intestinal and hepatic injury. Chest 2005; 128: 2677-2687.
15. Croughwell ND, Newman MF, Lowry E, Davis RD, Landolfo KP, White WD, Kirchner JL, Mythen MG: Effect of temperature during cardiopulmonary bypass on gastric mucosal perfusion. Br J Anaesth 1997; 78: 34-38.
16. Huddy SP, Joyce WP, Pepper JR: Gastrointestitial complications in 4,473 patients who underwent cardiopulmonary bypass surgery. Br J Surg 1991; 78: 293-296.
17. Sinclair DG, Haslam PL, Quinlan GJ, Pepper JR, Evans TW: The effect of cardiopulmonary bypass on intestinal and pulmonary endothelial permeability. Chest 1995; 108: 718-724.
18. Tofukuji M, Stahl GL, Metasis C, Tomita M, Agah A, Bianchi C, Fink MP, Sellke FW: Mesenteric dysfunction after cardiopulmonary bypass: role of complement C5a. Ann Thorac Surg 2000; 69: 799-807.
19. Cox CS, Cox CSJr, Allen SJ, Brennan M: Analysis of intestinal microvascular permeability associated with cardiopulmo-nary bypass. J Surg Res 1999; 83: 19-26.
20. Heltne JK, Koller ME, Lund T, Farstad M, Rynning SE, Bert JL, Husby P: Studies on fluid extravasation related to induced hypothermia during cardiopulmonary bypass in piglets. Acta Anaesthesiol Scand 2001; 45: 720-728.
21. Farstad M, Heltne JK, Rynning SE, Lund T, Mongstad A, Eliassen F, Husby P: Fluid extravasation during cardiopulmonary bypass in piglets – effect of hypothermia and different cooling protocols. Acta Anaesthesiol Scand 2003; 47: 397-406.
22. Farstad M, Kvalheim VL, Husby P: Cold-induced fluid extravasation during cardiopulmonary bypass in piglets can be counteracted by use of iso-oncotic prime. J Thorac Cardiovasc Surg 2005; 130: 287-294.

