© Borgis - Postępy Nauk Medycznych 3/2010, s. 195-198
*Olga Kozińska-Przybył, Andrzej Mróz, Magdalena Durlik
Hemolytic uremic syndrome (HUS) After Kidney Transplantation in Two Patients Treated With Sirolimus – case report
Zespół hemolityczno-mocznicowy u dwóch biorców przeszczepu nerkowego leczonych sirolimusem – opis przypadków
Klinika Medycyny Transplantacyjnej i Nefrologii Instytutu Transplantologii Warszawskiego Uniwersytetu Medycznego
Kierownik Kliniki: prof. dr hab. med. Magdalena Durlik
Streszczenie
Sirolimus, m-TOR inhibitor, poprzez wplyw na obnizenie VEGF w nerkach przeszczepionych, dzialanie proagragacyjne, moze wywolac rozwój mikroangiopatii zakrzepowej. Manifestacja kliniczna jest wówczas zespól hemolityczno-mocznicowy charakteryzujacy sie niedokrwistoscia hemolityczna, maloplytkowoscia oraz niewydolnoscia nerki przeszczepionej. Ponizej prezentujemy dwa przypadki pacjentów po zabiegach przeszczepienia nerek, którzy rozwineli zespól hemolityczno-mocznicowy podczas terapii sirolimusem. Zaden nie mial w wywiadzie zespolu hemolityczno-mocznicowego jako przyczyny niewydolnosci nerek wlasnych. Rozpoznanie mikroangiopatii zakrzepowej potwierdzono badaniem histopatologicznym wycinka nerki przeszczepionej pobranej podczas biopsji cienkoiglowej. Pomimo istnienia wielu czynników mogacych wplynac na rozwiniecie mikroangiopatii zakrzepowej jak: drugie przeszczepienie, leczenie takrolimusem, wysokie PRA (przypadek 1 i 2), DGF, poprzedzajace ostre odrzucanie humoralne (przypadek 2), dlugi czas niedokrwienia oraz starszy wiek dawcy ( przypadek 1), dopiero odstawienie rapamycyny poskutkowalo poprawa czynnosci przeszczepu. Potwierdza to teze o szkodliwym wplywie m-TOR inhibitorów na sródblonek naczyniowy w okresie ostrej mikroangiopatii zakrzepowej.
Summary
Sirolimus by its ability to lower VEGF in transplanted kidney and promotion of platelet aggregation can predispose to thrombotic microangiopathy (TMA), which can be severe. We identify two cases of TMA in renal transplant recipients, who were being treated with sirolimus. Clinically patients demonstrated hemolytic uremic syndrome. Neither patient had evidence of TMA as primary disease in native kidney. Diagnosis was based on histopathologic examination of renal graft specimen, C4d stainig was also performed. Both had additional risk factors for TMA development like: previous renal transplant, high PRA, treatment with tacrolimus (case 1 and 2), DGF, preceding humoral rejection episode (case 2), older donor age and long ischemic time. Only with the discontinuation of sirolimus showed renal graft improvement. This agrees with the theory that sirolimus has an damaging effect on endothelial cells, moreover in cases with acute TMA.

Introduction
HUS consisting of hemolytic anemia, thrombocytopenia, and acute renal failure, is clinical manifestation of thrombotic microangiopathy (TMA) diagnosed by histopathologic examination of a biopsied kidney specimen. It occurs in 5-15% of patients who receive cyclosporine and in approximately 1-5% of those who are given tacrolimus (6, 7). TMA is being reported with increasing frequency (8) also in patients receiving sirolimus-based immunosuppressant drugs regimen (9). Recent experimental studies showed that sirolimus itself can cause thrombotic microangiopathy and delay healing process after TMA. We present cases of two patients who developed HUS after treatment of combined FK506/ATG/Sirolimus regimen and fully recovered after discontinuation of sirolimus.
Case #1
26-years old patient with end stage renal failure caused by chronic pyelonephritis underwent second cadaver renal allograft from 50 year old donor. Due to high immunisation (max. PRA was 74%, last 36%) immunosupression was started with ATG – fresenius (1-st dose 9 mg/kg), methylprednisolone (250 mg for day 0), tacrolimus (initially 0.2 mg/kg per day) and sirolimus ( first dose 6 mg). ATG was reduced to the dose of 3 mg/kg (3 doses) under the control of number of CD 3 plus cells. The graft functioned immediately and serum creatinine dropped from 4 mg/dl to 3.3 mg/dl on post-operative day 6. From that time, no further improvement in graft function was observed. On day 13 post-transplant, graft function started to deteriorate (serum creatinine 3.8 mg/dl) with normal graft perfusion on colored doppler study. Anemia and thrombocytopenia were primary considered to be consistent with ATG myelotoxicity (fall in hemoglobin 9.3-6.2 g/l; fall in platelet count 254-76 x 10 9/l). Whole blood 12-h through tacrolimus, and 24-h through levels of sirolimus were within therapeutic ranges (FK: min. 7.2 ng/dl, max. 10.2 ng/dl, Rapa 4.5). There were no biochemical signs of hemolysis, however there were high LDH levels (1554 U/L, normal range 80-248 U/L). In the first core biopsy vascular changes can be seen. Nearly total occlusion of majority of arteries due to non-inflammatory mucoid-like intimal proliferation was observed (fig. 1). C4d deposits were found; additionally in some vessels homogenic acidophilic deposits interpreted as fibrin were present. These changes of thrombotic angiopathy were not accompanied by acute rejection nor were remarkable chronic interstitial features found. The clinical picture of intravascular haemolysis, thrombocytopenia, and worsening renal function with microangiopathy in histopathology examination was primary assumed to be tacrolimus – inducted haemolytic-uremic syndrome (HUS). Tacrolimus was discontinued and mycophenolate mophetil was started in a dose of 1.0 g per day then raised to 2.0 g per day. Neither plasmapheresis nor fresh frozen plasma was employed, instead methylprednisolone was given as a prophylaxis of acute rejection in highly immunized patient (3 x 500 mg, then 10 x 125 mg). There was no renal graft function improvement; however whole blood sirolimus level was maintained on 3.0 ng/ml. The second biopsy performed on 25 day displayed similar arterial changes of mucoid-like intimal proliferation with nearly complete occlusion of vascular lumen, so the diagnosis of thrombotic angiopathy was sustained (fig. 2), C4d deposits were not found. Vascular disturbances resulted in significant ischaemia that led to cortical necrosis, therefore sirolimus was discontinued and fast normalization of renal function was observed (fall in creatinine to 1.8 mg/dl).

Fig. 1. Arterial intimal mucoid-like proliferation.
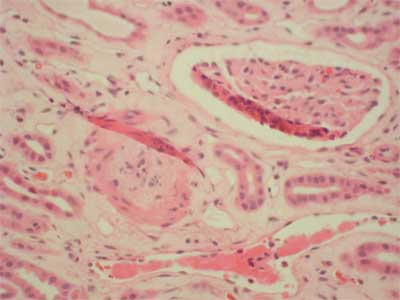
Fig. 2. Arterial intimal proliferation.
Case #2
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Franco A, Hernandez D, Capdevilla L et al.: De novo hemolytic uremic syndrome/thrombotic microangiopathy in renal transplant patients receiving calcineurin inhibitors; role of sirolomus. Transpl Proc 2003; 35: 1764-1766.
2. Sartelet H, Toupance O, Lorenzato M et al.: Sirolimus-inducted thrombotic microangiopaty is associated with decreased expression of vascular endothelial growth factor in kidneys. Am J Transplt 2005; 5: 2441-2447.
3. Letavernier E, Bruneval P, Vandermeersch S et al.: Sirolimus interacts with pathways essential for podocyte integrity. Nephrology, Dialysis, Transplantation. Eynsham: Feb 2009; 24: 630.
4. Trimarchi HM, Truong LD, Brennan S et al.: FK – 506 associated thrombotic microangiopathy: report of two cases and review of the literature. Transplantation 1999; 67: 539-544.
5. Keller K, Daniel Ch, Schocklmann H et al.: Everolimus inhibits glomerular endothelial proloferation and VEGF, but not long-term recovery in experimental thrombotic microangiopaty. Nephrol Dial Transplt 2006; 21: 2724-2735.
6. Zafiran A, Meleg-Smith S, ODonovan R et al.: Cyclosporine-associated thrombotic microangiopathy in renal allografts. Kidney Int 1999; 55: 2457-66.
7. Ruggeneti P: Post-transplantation hemolitic uremic syndrome. Kidney Int 2002; 62: 1093-104.
8. Reynold JC, Agodoa LY, Yuan CM et al.: Thrombotic microangiopathy after renal tranpslantation in the United States. Am J Kidney Diss 2003; 42: 1058-68.
9. Barone GW, Gurley BJ, Abul-Ezz SR: Gokden N Sirolimus-inducted thrombotic microangiopathy in a renal transplant recepipients. Am J Kidney Dis 2003; 42: 202-206.
10. de Vries B, Walter SJ, Peutz-Kootstra CJ et al.: The mannose-binding lectin-pathway is involved in complement activation in the course of renal ischemia-reperfusion injury. Am J Pathol 2004; 165: 1677-88.
11. Robson M, Cote I, Abbs I et al.: Thrombotic micro-angiopathy with sirolimus-based immunosupresion: potentation of calcyneurin-inhibitor-inducted endothelial damage? Am J Transplant 2003; 3: 324-327.
12. Saikali JA, Truong LD, Suki WN: Sirolimusmay promotethrombotic microangiopathy. Am J Transplant 2003; 3: 229-230.
13. Babinska A, Markell MS, Salifu MO et al.: Enhancement of human platelet aggregation and secretioninducted by rapamycin. Nephrol Dial Transplant 1998; 13: 3153-9.


