© Borgis - Postępy Fitoterapii 3/2016, s. 189-199
Marta Sarnowska, *Anna Gawron-Gzella
Rooibos (Aspalathus linearis (Burm. f.) R. Dahlgren) – substancje biologicznie aktywne i działanie farmakologiczne
Rooibos (Aspalathus linearis (Burm. f.) R. Dahlgren) – biological active substances and farmacological activity
Katedra i Zakład Farmakognozji, Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu
Kierownik Katedry i Zakładu: prof. dr hab. n. farm. Wiesława Bylka
Streszczenie
Prezentowana praca stanowi przegląd literatury dotyczącej Aspalathus linearis (Burm. f.) R. Dahlgren (Rooibos), rośliny endemicznej Południowej Afryki, popularnej ze względu na smak i aromat sporządzanej z niej ziołowej herbaty. Przedstawiono: wygląd morfologiczny tej rośliny, występowanie, skład chemiczny i aktywność farmakologiczną. Głównymi związkami biologicznie czynnymi A. linearis są flawonoidy, szczególnie unikalne dihydrochalkony – aspalatyna i notofagina. Działanie lecznicze rośliny zostało udowodnione w licznych badaniach in vitro, na modelach komórkowych i zwierzęcych, a nawet w badaniach klinicznych na ochotnikach. Działanie farmakologiczne naparów z Rooibos jest związane z ich wysoką aktywnością przeciwutleniającą i dlatego mogą one być użyteczne w zapobieganiu i leczeniu wielu chorób neurodegeneracyjnych, chorób układu sercowo-naczyniowego, cukrzycy, otyłości, uszkodzenia wątroby, a nawet nowotworów. Z powodu niskiej toksyczności, braku kofeiny, niskiej zawartości garbników, wysokiej zawartości żelaza i innych mikroelementów Rooibos może być bezpiecznie podawany dzieciom, kobietom w ciąży oraz stanowić alternatywę dla kawy lub herbaty.
Summary
The presented paper is a review of literature on Aspalathus linearis (Burm. f.) R. Dahlgren (Rooibos) – an endemic South African plant, valued for the taste and aroma of the herbal tea made from it. The morphological appearance, occurrence, phytochemical composition and pharmacological activity of this plant were presented. The main biologically active compounds of A. linearis are flavonoids, especially unique dihydrochalcones – aspalathin and nothofagin. The therapeutic effect of this plant has been proven by numerous in vitro studies, on cell and animal models, and even in clinical studies on volunteers. The pharmacological activity of Rooibos infusions is associated with their high antioxidant activity, and may, therefore, be useful in prevention and treatment of several neurodegenerative diseases, cardiovascular diseases, diabetes, liver damage and even cancer. Due to low toxicity, lack of caffeine, a low tannin content, a high content of iron and other microelements, Rooibos can be safely administered to children, pregnant women, and offer an alternative to coffee or tea.

Wstęp
Nazwa Rooibos określa zarówno południowoafrykańską roślinę Aspalathus linearis (aspalat prosty), jak i produkowany z liści i łodyg tej rośliny napój (herbatę) o przyjemnym smaku i cennych właściwościach zdrowotnych (1). Mimo iż dystrybucja Rooibos poza miejsce jego naturalnego występowania rozpoczęła się dopiero w XX wieku, to produkt ten, zaliczany obecnie do żywności funkcjonalnej, szybko zdobywa zwolenników. Napój jest ceniony głównie z powodu braku kofeiny i niskiej zawartości garbników, a także wysokiej zawartości flawonoidów i związków mineralnych (2).
Przynależność systematyczna i morfologia A. linearis
Aspalathus linearis (Burm. f.) R. Dahlgren (aspalat prosty) według systemu APG III (zgodnego z klasyfikacją filogenetyczną roślin telomowych) należy do rodziny Fabaceae (Bobowatych), plemienia Crotalarieae i liczącego około 300 gatunków rodzaju Aspalathus (aspalat). Aspalat prosty lepiej znany jest jako Rooibos, czerwonokrzew, red bush, rotbush, a w języku afrykanerskim – koopmanstee, naaldtee, rooibostee, speldtee, swarttee (3).
W obrębie gatunku A. linearis istnieje silne zróżnicowanie morfologiczne, genetyczne, chemiczne i funkcjonalne. Na podstawie pokroju rośliny, koloru liści, kwiatów, przystosowania do przetrwania pożaru oraz składu chemicznego, zwłaszcza rodzaju związków polifenolowych, rozróżnia się 7 zasadniczych biotypów (4). Z kolei biorąc pod uwagę preferencje siedliskowe, wyróżnia się 5 ekotypów tego gatunku (1).
Główna, komercyjna odmiana A. linearis, jest gęsto rozgałęzionym krzewem, o jednolicie żółtych kwiatach, osadzonych na szypułkach i zwykle cienkich, jasnozielonych liściach. Inne odmiany mają często szarawozielone, najczęściej nagie lub delikatnie omszone liście oraz małe, żółte lub czerwonożółte kwiaty ze spiczastą linią grzbietową (4, 5). Aspalat prosty ma mocny korzeń palowy o długości ok. 2 metrów, dzięki czemu jest uważany za cenną roślinę pionierską i odtwarzającą strukturę gleby po pożarze. Owocem jest lancetowaty i puszysty strąk, zawierający pojedyncze, małe, żółte, nerkowate nasienie (1, 2).
Występowanie
Rodzaj Aspalathus jest endemiczny dla Południowej Afryki. Występuje na terenie najmniejszego na świecie państwa florystycznego – Państwa Przylądkowego (Capensis), tylko w obrębie formacji roślinnej Fynbos w górach Cederberg, rozciągających się w zachodnich i południowo-wschodnich częściach prowincji Western Cape oraz w południowo-zachodniej części prowincji Northern Cape (1). Rooibos wymaga klimatu typu śródziemnomorskiego. A. linearis nie rośnie poniżej 450 m n.p.m., a kwitnie tylko powyżej 900 m n.p.m. Młode rośliny są wrażliwe na mróz i śnieg, za to dojrzałe dobrze znoszą surowe zimy i gorące lata. Gatunek jest przystosowany do głębokich, dobrze przepuszczalnych piasków, ubogich w składniki odżywcze, bardzo kwaśnych (pH 3-3,5), typowych dla terenów górskich. Próby rozprzestrzenienia A. linearis na inne tereny Południowej Afryki zakończyły się niepowodzeniem (1, 2, 5).
Uprawa, produkcja i parzenie herbaty Rooibos
Aspalathus linearis jest jedną z roślin, które przeszły transformację z lokalnego naturalnie rosnącego surowca, do ważnej rośliny uprawnej (6). Wykorzystanie przez miejscową ludność herbaty z Rooibos pochodzącej z naturalnych stanowisk było znane już w XVIII w., ale dopiero w latach 30. XX wieku dzięki Le Frais Nortier – angielskiemu lekarzowi, zafascynowanemu korzyściami zdrowotnymi herbaty z tego gatunku, rozpoczęto eksperymenty, prowadzące do uprawy tej rośliny i umożliwiające sukces dzisiejszego przemysłu. Obecnie uprawiana jest tylko jedna odmiana – A. linearis Nortier. Ponad 90% komercyjnego produktu otrzymuje się z tej odmiany, natomiast wciąż są zbierane z naturalnych stanowisk odmiany Wupperthal i Nieuwoudtville, jako produkty specjalistyczne (1, 7, 8).
Rośliny są gotowe do zbioru surowca po 2 latach od ich posadzenia, dając maksymalny plon po 3 latach. Z dojrzałego krzewu otrzymuje się 110-220 gramów herbaty. Rośliny mogą żyć do 20 lat, natomiast na plantacjach najczęściej są utrzymywane przez 6-7 lat, gdyż z czasem drewnieją (2). W ostatnich dekadach obserwuje się znaczący wzrost zapotrzebowania na Rooibos. Odbiorcami są niemal wszystkie kraje świata, od Australii, Nowej Zelandii i Europy do Japonii, Kanady i USA (2, 7, 9). Ilość produktu na światowych rynkach wzrosła w ciągu 10 lat z 750 ton (1993 r.) do 5964 ton (2003 r.), a w roku 2007 osiągnęła wartość 7176 ton (9).
Produkcja herbaty jest procesem długotrwałym. Latem ścinane są szczytowe części roślin o długości ok. 45 cm, a po zwiędnięciu w specjalnych halach są cięte na drobne, ok. 0,5 cm odcinki, rozsypywane na betonowych platformach i gniecione przez traktory, następnie przewracane i zwilżane kilka razy wodą dla wzmocnienia naturalnego procesu enzymatycznego utleniania. W kolejnym etapie, ułożony w kopce i przykryty na 24 godz. surowiec jest poddawany fermentacji, w trakcie której liście z zielonych stają się intensywnie bursztynowe. Powstała w ten sposób czerwono-brązowa masa jest rozkładana cienkimi warstwami i suszona na słońcu do osiągnięcia ok. 11% wilgoci. Po około 3-miesięcznym przechowywaniu, Rooibos jest pakowany i kierowany do obrotu (2).
Bardziej wartościowy, głównie ze względu na większą ilość aspalatyny, jest tzw. zielony Rooibos. Podczas jego produkcji proces utleniania jest celowo hamowany – inaktywacja enzymów następuje poprzez poddanie surowca działaniu pary wodnej lub podsuszaniu niepociętych pędów w niskiej temperaturze i przy małej wilgotności powietrza. Następnie surowiec jest rozdrabniany i suszony do wymaganej wilgotności (7, 10, 11).
Surowiec do przygotowywania herbaty Rooibos składa się z fragmentów liści i czubków łodyg o długości ok. 0,5 cm. Liście są spłaszczone, a delikatnie żeberkowane młode łodygi wskutek pocięcia są bardzo podobne do rozdrobnionych liści (7).
W celu sporządzenia naparu z A. linearis zaleca się zalanie wrzątkiem 1,5 g surowca lub jednej torebki typu fix na filiżankę i parzenie przez 8-10 min. Polecana jest zarówno gorąca, jak i mrożona herbata Rooibos, która może być słodzona cukrem lub sokami owocowymi albo podawana z mlekiem (2, 12).
Skład chemiczny
Najliczniejszą grupę związków czynnych A. linearis stanowią związki fenolowe – zawartość sumy polifenoli w ekstrakcie wodnym sięga 252 mg/g, a etanolowym 234 mg/g (13). Dotychczas potwierdzono obecność ok. 30 różnorodnych związków fenolowych, głównie flawonoidów, licznych kwasów fenolowych oraz fenylopropanoidów, a także niewielkie ilości garbników, fenyloetanoidów i kumaryn (13-16).
Spośród związków flawonoidowych w A. linearis można wyróżnić: dihydrochalkony, flawony, flawonole i flawanony. Całkowita zawartość flawonoidów wynosi 5,52 mg/g w ekstrakcie wodnym i 6,70 mg/g w ekstrakcie alkoholowym (10).
Najważniejszą grupę, z punktu widzenia aktywności A. linearis, stanowią dihydrochalkony. W roślinie tej są obecne dwa C-glikozydy dihydrochalkonu: aspalatyna (3?-C-β-D-glukopiranozyd 2?,3,4,4?,6?-pentahydroksydihydrochalkonu) – występująca wyłącznie w A. linearis i notofagina (3?-C-β-D-glukopiranozyd 2?,4,4?,6?-tetrahydroksydihydrochalkonu) – znaleziona tylko w Nothofagus fusca, Schoepfia chinensis i A. linearis, a także aspalalinina – C-glukozyd cyklicznego dihydrochalkonu (ryc. 1) (13-18).
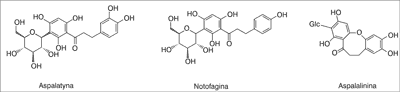
Ryc. 1. Dihydrochalkony obecne w A. linearis (13)
Najliczniejszą grupę flawonoidów stanowią flawony: luteolina i chryzoeriol oraz C-glikozydy flawonowe: pochodne apigeniny (witeksyna, izowiteksyna i wicenina-2), chryzeoriolu (skoparyna) oraz luteoliny (orientyna, izoorientyna, karlinozyd, jego izomer neokarlinozyd oraz izokarlinozyd) (ryc. 2). Ponadto obecne są O-glikozydy flawonowe, m.in. 7-O-glukozyd luteoliny (cynarozyd) oraz 2”-0-β-arabinopiranozyd orientyny (13-20).
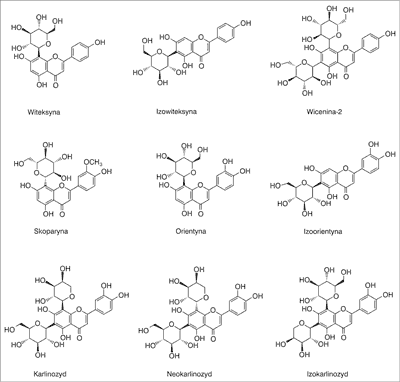
Ryc. 2. Niektóre flawony obecne w A. linearis (13)
W A. linearis zidentyfikowano ponadto 7 flawonoli, poza 7-glukozydem patuletyny, także kwercetynę i jej 5 glikozydów: hiperozyd, izokwercytrynę, rutynę, 3-O-robinobiozyd oraz 3-O-arabinoglukozyd kwercetyny (13-16, 18).
Z grupy flawanonów w A. linearis wykryto 4 pochodne eriodykcjolu: (S)- i (R)-6-C-D-glukopiranozyd oraz (S)- i (R)-8-C-D-glukopiranozyd eriodykcjolu, czyli enancjomery 2,3-dihydroizoorientyny i 2,3-dihydroorientyny (ryc. 3). Związki te powstają wskutek fotochemicznej konwersji aspalatyny na diastereoizomeryczną mieszaninę flawanonów podczas fermentacji rośliny. W wyciągu z aspalatu wykryto także 5,3’-di-O-glukozyd eriodykcjolu oraz 5-glukozyd naryngeniny (hemiflorynę) (10, 13, 15, 16, 20, 21).
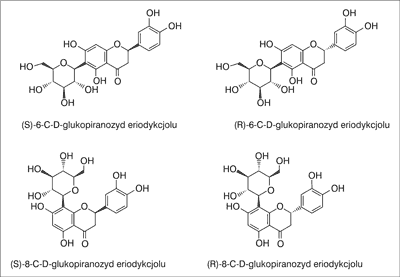
Ryc. 3. Flawanony obecne w A. linearis (13)
W A. linearis obecne są liczne kwasy fenolowe pochodne kwasu benzoesowego: galusowy, protokatechowy, α-rezorcylowy, gentyzynowy, p-hydroksybenzoesowy, wanilinowy, syryngowy i salicylowy oraz pochodne kwasu hydroksycynamonowego: kawowy, p-kumarowy, ferulowy, synapinowy, chlorogenowy i 3,4,5-trihydroksycynamonowy (15, 20).
Z grupy fenyloetanoidów wykryto tyrozol (p-hydroksyfenyloetanol) i glikol 3-metoksy-4-hydroksyfenylowy (16, 20). Przedstawicielem fenylopropanoidów jest 2-O-glukozyd kwasu fenylopirogronowego (PPAG) odpowiedzialny za właściwości przeciwcukrzycowe (14) oraz syryngina (16) i safflomina A, będąca C-glukozydową pochodną kwasu cynamonowego (13).
Aspalathus linearis wyróżnia się niską, w porównaniu do czarnej herbaty, zawartością garbników. Zidentyfikowano jedynie (+)-katechinę występującą w bardzo małym stężeniu (15, 20) oraz oligomeryczne flawan-3-ole: procyjanidynę B3 i bis-fisetinidol-(4,6:4,8)-katechiny (20, 22).
Badanie metodą chromatografii gazowej sprzężonej ze spektrometrią mas pozwoliło na wykrycie ponad 200 różnych związków lotnych odpowiedzialnych za aromat surowca, należących przede wszystkim do laktonów oraz aldehydów, alkoholi, ketonów, estrów, eterów, węglowodorów i kwasów. Zidentyfikowano m.in. gwajakol (24,0%) oraz dihydroaktynidiolid, β-jonon, 5,6-epoksyjonon, octan geraniolu, benzaldehyd, kwas kapronowy i β-damascenon (23, 24).
Spośród wielu związków mineralnych w najwyższym stężeniu są obecne: potas, sód, magnez i wapń, odpowiednio 4083, 2467, 2360 i 2130 μg/g liści, a następnie fosfor, glin, żelazo i mangan oraz niewielkie ilości miedzi, boru, cynku i fluoru (2, 20).
Ponadto w A. linearis potwierdzono obecność dwóch kumaryn eskuliny i eskuletyny (15, 16), lignanów: sekoizolarycyrezynolu, jego O-glikozydu i wladinolu F (16); zidentyfikowano też (+)-pinitol i nukleozyd urydyny (21) oraz 6-C-glukozyd 5,7-dihydroksychromonu, który jest prekursorem flawonoidów (13).
Jedną z najczęściej podkreślanych zalet herbaty Rooibos jest brak kofeiny i innych alkaloidów, poza śladowymi ilościami sparteiny (9, 25).
Działanie farmakologiczne
Najwcześniejsze publikacje na temat herbaty Rooibos skupiają się na jej walorach jako napoju, natomiast badania właściwości biologicznych rozpoczęto dopiero w drugiej połowie XX wieku i cały czas są one kontynuowane. Wyniki prac in vitro i in vivo oraz nielicznych badań klinicznych pozwalają na stwierdzenie, że aspalat prosty ma wielokierunkowe działanie lecznicze (9, 20).
Aktywność przeciwutleniająca
Zmiatanie wolnych rodników jest jednym z najlepiej udokumentowanych działań A. linearis, w szczególności dla występującej wyłącznie w tej roślinie aspalatyny (9, 18, 20, 26-28).
Pierwsze badania aktywności przeciwutleniającej naparów z A. linearis prowadzono z wykorzystaniem wolnego rodnika DPPH w porównaniu z działaniem naparów z herbaty zielonej, czarnej i oolong. Napary z niefermentowanego Rooibos wykazały wyższą aktywność od fermentowanego, ale niższą niż zielona herbata (27). W teście Rancimat aktywność naparów z Rooibos była wyższa, jeśli czas parzenia został wydłużony do 30 min (29).
W kolejnych testach z wykorzystaniem rodnika nadtlenkowego oraz DPPH oceniono aktywność przeciwutleniającą herbaty Rooibos na różnych etapach jej produkcji. Udowodniono, że największy spadek aktywności następuje podczas fermentacji, a przesiewanie, suszenie na słońcu czy pasteryzacja w mniejszym stopniu wpływają na działanie przeciwwolnorodnikowe. Potwierdzono też wyższą aktywność surowca niefermentowanego (30).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Hawkins H-J, Malgas R, Biènabe E. Ecotypes of wild Rooibos (Aspalathus linearis (Burm. F.) Dahlg., Fabaceae) are ecologically distinct. South Afr J Bot 2011; 77(2):360-70. 2. Morton JF. Rooibos tea, Aspalathus linearis, a caffeineless, low-tannin beverage. Econ Bot 1983; 37(2):164-73. 3. ITIS – Integrated Taxonomic Information System); www.itis.gov/servlet/SingleRpt/SingleRpt ?search_topic=TSN&search_value=506239&. 4. Van Heerden FR, Van Wyk BE, Viljoen AM i wsp. Phenolic variation in wild populations of Aspalathus linearis (Rooibos tea). Biochem Syst Ecol 2003; 31(8):885-95. 5. Lötter D, Le Maitre D. Modelling the distribution of Aspalathus linearis (Rooibos tea): implications of climate change for livelihoods dependent on both cultivation and harvesting from the wild. Ecol Evol 2014; 4(8):1209-21. 6. Van der Bank M, Van Wyk BE, Van der Bank FH. Biochemical genetic variation in four wild populations of Aspalathus linearis (Rooibos tea). Biochem Syst Ecol 1995; 23(3):257-62. 7. Kotina EL, Stepanova AV, Tilney PM i wsp. The pharmacognostic value of leaf and stem anatomy in Rooibos tea (Aspalathus linearis). South Afr J Bot 2012; 82:129-33. 8. Malgas RR, Potts AJ, Oettlè NM i wsp. Distribution, quantitative morphological variation and preliminary molecular analysis of different growth forms of wild Rooibos (Aspalathus linearis) in the northern Cederberg and on the Bokkeveld Plateau. South Afr J Bot 2010; 76(1):72-81. 9. Joubert E, De Beer D. Rooibos (Aspalathus linearis) beyond the farm gate: From herbal tea to potential phytopharmaceutical. South Afr J Bot 2011; 77(4):869-86. 10. Bramati L, Minoggio M, Gardana C i wsp. Quantitative characterization of flavonoid compounds in Rooibos tea (Aspalathus linearis) by LC-UV/DAD. J Agric Food Chem 2002; 50:5513-9. 11. Joubert E, Schultz H. Production and quality aspects of Rooibos tea and related products. A review. J Appl Bot Food Qual 2006; 80(2):138-44. 12. Zittlau J. Herbata Rooibos dla zdrowia i urody. Ludwig, PPK Astra, Poznań 2000: 80. 13. Iswaldi I, Arráez-Román D, Rodríguez-Medina I i wsp. Identification of phenolic compounds in aqueous and ethanolic Rooibos extracts (Aspalathus linearis) by HPLC-ESI-MS (TOF/IT). Anal Bioanal Chem 2011; 400(10):3643-54. 14. Beelders T, Kalili KM, Joubert E i wsp. Comprehensive two-dimensional liquid chromatographic analysis of Rooibos (Aspalathus linearis) phenolics: Liquid chromatography. J Sep Sci 2012; 35(14):1808-20. 15. Krafczyk N, Glomb MA. Characterization of phenolic compounds in Rooibos tea. J Agric Food Chem 2008; 56(9):3368-76. 16. Shimamura N, Miyase T, Umehara K i wsp. Phytoestrogens from Aspalathus linearis. Biol Pharm Bull 2006; 29(6):1271-4. 17. De Beer D, Malherbe CJ, Beelders T i wsp. Isolation of aspalathin and nothofagin from Rooibos (Aspalathus linearis) using high-performance countercurrent chromatography: Sample loading and compound stability considerations. J Chromatogr A 2015; 1381:29-36. 18. Stalmach A, Mullen W, Pecorari M i wsp. Bioavailability of C-linked dihydrochalcone and flavanone glucosides in humans following ingestion of unfermented and fermented Rooibos teas. J Agric Food Chem 2009; 57(15):7104-11. 19. Cabooter D, Broeckhoven K, Kalili KM i wsp. Fast method development of Rooibos tea phenolics using a variable column length strategy. J Chromatogr A 2011; 1218(41):7347-57. 20. Joubert E, Gelderblom WCA, Louw A i wsp. South African herbal teas: Aspalathus linearis, Cyclopia spp. and Athrixia phylicoides – a review. J Ethnopharmacol 2008; 119(3):376-412. 21. Marais C, Janse van Rensburg W, Ferreira D i wsp. (S)- and (R)-Eriodictyol-6-C-β-d-glucopyranoside, novel keys to the fermentation of Rooibos (Aspalathus linearis). Phytochem 2000; 55:43-9. 22. Ferreira D, Marais C, Steenkamp JA, Joubert E. Rooibos tea as a likely health food supplement. [In:] Proceeding of Recent Development of Technologies on Fundamental Foods for Health. Korean Society of Food, Science and Technology. Seoul, Korea 1995; 73-88. 23. Kawakami M, Kobayashi A, Kator K. Volatile constituents of Rooibos tea (Aspalathus linearis) as affected by extraction process. J Agric Food Chem 1993; 41(4):633-6. 24. Habu T, Flath RA, Mon TR i wsp. Volatile components of Rooibos tea (Aspalathus linearis). J Agric Food Chem 1985; 33(2):249-54. 25. Van Wyk BE, Verdoorn GH. Alkaloids of the genera Aspalathus, Rafnia and Wiborgia (Fabaceae, Crotalarieae). S Afr Tydskr Plantk 1989; 55(5):520-2. 26. McKay DL, Blumberg JB. A review of the bioactivity of South African herbal teas: Rooibos (Aspalathus linearis) and Honeybush (Cyclopia intermedia). Phytother Res 2007; 21:1-16. 27. Von Gadow A, Joubert E, Hansmann CF. Comparison of the antioxidant activity of Rooibos tea (Aspalathus linearis) with green, oolong and black tea. Food Chem 1997; 60:73-7. 28. Von Gadow A, Joubert E, Hansmann CF. Comparison of the antioxidant activity of aspalathin with that of other plant phenols of Rooibos tea (Aspalathus linearis), alphatocopherol, BHT and BHA. J Agric Food Chem 1997; 45:632-8. 29. Von Gadow A, Joubert E, Hansmann CF. Effect of extraction time and additional heating on the antioxidant activity of Rooibos tea (Aspalathus linearis) extracts. J Agric Food Chem 1997; 45:1370-4. 30. Standley L, Winterton P, Marnewick JL i wsp. Influence of processing stages on antimutagenic and antioxidant potentials of Rooibos tea. J Agric Food Chem 2001; 49(1):114-7. 31. Paździoch-Czochra M, Wideńska A. Spectrofluorimetric determination of hydrogen peroxide scavenging activity. Anal Chim Acta 2002; 452:177-84. 32. Schulz H, Joubert E, Schütze W. Quantification of quality parameters for reliable evaluation of green Rooibos (Aspalathus linearis). Eur Food Res Technol 2003; 216:539-43. 33. Bramati L, Aquilano F, Pietta P. Unfermented Rooibos tea: quantitative characterization of flavonoids by HPLC-UV and determination of the total antioxidant activity. J Agric Food Chem 2003; 51:7472-4. 34. Joubert E, Winterton P, Britz TJ i wsp. Superoxide anion and alpha, alpha-diphenyl-beta-picrylhydrazyl radical scavenging capacity of Rooibos (Aspalathus linearis) aqueous extracts, crude phenolic fractions, tannin and flavonoids. Food Res Intern 2004; 37:133-8. 35. Snijman PW, Joubert E, Ferreira D i wsp. Antioxidant activity of the dihydrochalcones aspalathin and nothofagin and their corresponding flavones in relation to other Rooibos (Aspalathus linearis) flavonoids, epigallocatechin gallate, and trolox. J Agric Food Chem 2009, 57:6678-84. 36. Joubert E, De Beer D. Phenolic content and antioxidant activity of Rooibos food ingredient extracts. J Food Compos Anal 2012; 27:45-51. 37. Simpson MJ, Hjelmqvist D, López-Alarcón C i wsp. Anti-peroxyl radical quality and antibacterial properties of Rooibos infusions and their pure glycosylated polyphenolic constituents. Molecules 2013; 18(9):11264-80. 38. Orzel J, Daszykowski M, Kazura M i wsp. Modeling of the total antioxidant capacity of Rooibos (Aspalathus linearis) tea infusions from chromatographic fingerprintsand identification of potential antioxidant markers. J Chromatogr A 2014; 1366:101-9. 39. Marnewick JL, Joubert E, Swart P i wsp. Modulation of hepatic drug metabolizing enzymes and oxidative status by Rooibos (Aspalathus linearis) and Honeybush (Cyclopia intermedia), green and black (Camellia sinensis) Teas in Rats. J Agric Food Chem 2003; 51:8113-9. 40. Kucharská J, Uličná O, Gvozdjáková A i wsp. Regeneration of coenzyme q9 redox state and inhibition of oxidative stress by Rooibos tea (Aspalathus linearis) administration in carbon tetrachloride liver damage. Physiol Res 2004; 53:515-21. 41. Uličná O, Greksak M, Vančová O i wsp. Hepatoprotective effect of Rooibos tea (Aspalathus linearis) on CCl4-induced liver damage in rats. Physiol Res 2003; 52:461-6. 42. Uličná O, Vančová O, Bošek P i wsp. Rooibos Tea (Aspalathus linearis) Partially prevents oxidative stress in streptozotocin-induced diabetic rats. Physiol Res 2006; 55:157-64. 43. Hong IS, Lee HY, Kim HP. Anti-oxidative effects of Rooibos tea (Aspalathus linearis) on immobilization-induced oxidative stress in rat brain. Plos One 2014; 9(1):e87061. 44. Ajuwon OR, Oguntibeju OO, Marnewick JL. Amelioration of lipopolysaccharide-induced liver injury by aqueous Rooibos (Aspalathus linearis) extract via inhibition of pro-inflammatory cytokines and oxidative stress. BMC Complement Altern Med 2014; 14:392. 45. Baba H, Ohtsuka Y, Haruna H i wsp. Studies of anti-inflammatory effects of Rooibos tea in rats. Pediatr Int 2009; 51(5):700-4. 46. Lee W, Bae JS. Anti-inflammatory effects of aspalathin and nothofagin from Rooibos (Aspalathus linearis) in vitro and in vivo. Inflammation 2015; 38(4):1502-16. 47. Ku SK, Kwak S, Kim Y i wsp. Aspalathin and nothofagin from Rooibos (Aspalathus linearis) inhibits high glucose-induced inflammation in vitro and in vivo. Inflammation 2015; 38(1):445-55. 48. Almajano MP, Carbo R, Jimènez JAL i wsp. Antioxidant and antimicrobial activities of tea infusions. Food Chem 2008; 108(1):55-63. 49. Boyanova L. Comparative evaluation of the activity of plant infusions against Helicobacter pylori strains by three methods. World J Microb Biot 2014; 30:1633-7. 50. Mazibuko SE, Muller CJ, Joubert E i wsp. Amelioration of palmitate-induced insulin resistance in C2C12 muscle cells by Rooibos (Aspalathus linearis). Phytomed 2013; 20(10):813-9. 51. Kamakura R, Son MJ, De Beer D i wsp. Antidiabetic effect of green Rooibos (Aspalathus linearis) extract in cultured cells and type 2 diabetic model KK-Ay mice. Cytotechnol 2015; 67:699-710. 52. Son MJ, Minakawa M, Miura Y i wsp. Aspalathin improves hyperglycemia and glucose intolerance in obese diabetic ob/ob mice. Eur J Nutr 2013; 52(6):1607-19. 53. Kawano A, Nakamura H, Hata S i wsp. Hypoglycemic effect of aspalathin, a Rooibos tea component from Aspalathus linearis, in type 2 diabetic model db/db mice. Phytomed 2009; 16(5):437-43. 54. Muller CJF, Joubert E, De Beer D i wsp. Acute assessment of an aspalathin-enriched green Rooibos (Aspalathus linearis) extract with hypoglycemic potential. Phytomed 2012; 20(1):32-9. 55. Ayeleso A, Brooks N, Oguntibeju O. Modulation of antioxidant status in streptozotocin-induced diabetic male wistar rats following intake of red palm oil and/or Rooibos. Asian Pac J Trop Med 2014; 7(7):536-44. 56. Muller CJF, Joubert E, Pheiffer C i wsp. Z-2-(β-D-glucopyranosyloxy)-3-phenylpropenoic acid, an α-hydroxy acid from Rooibos (Aspalathus linearis) with hypoglycemic activity. Mol Nutr Food Res 2013; 57:2216-22. 57. Sanderson M, Mazibuko SE, Joubert E i wsp. Effects of fermented Rooibos (Aspalathus linearis) on adipocyte differentiation. Phytomed 2014; 21(2):109-17. 58. Beltrán-Debón R, Rull A, Rodríguez-Sanabria F i wsp. Continuous administration of polyphenols from aqueous Rooibos (Aspalathus linearis) extract ameliorates dietary-induced metabolic disturbances in hyperlipidemic mice. Phytomed 2011; 18(5): 414-24. 59. Marnewick J, Batenburg W, Swart P i wsp. Ex vivo modulation of chemical-induced mutagenesis by subcellular liver fractions of rats treated with Rooibos (Aspalathus linearis) tea, honeybush (Cyclopia intermedia) tea, as well as green and black (Camellia sinensis) teas. Mutat Res 2004; 558(1-2):145-54. 60. Van der Merwe JD, Joubert E, Richards ES i wsp. A comparative study on the antimutagenic properties of aqueous extracts of Aspalathus linearis (Rooibos), different Cyclopia spp. (honeybush) and Camellia sinensis teas. Mutat Res 2006; 611(1-2):42-53. 61. Snijman PW, Swanevelder S, Joubert E i wsp. The antimutagenic activity of the major flavonoids of Rooibos (Aspalathus linearis): Some dose-response effects on mutagen activation-flavonoid interactions. Mutat Res 2007; 631:111-23. 62. Edenharder R, Sager JW, Glatt H i wsp. Protection by beverages, fruits, vegetables, herbs, and flavonoids against genotoxicity of 2-acetylaminofluorene and 2-amino-1-methyl-6-phenyl-imidazo[4,5-b]pyridine (PhIP) in metabolically competent V79 cells. Mutat Res 2002; 521(1):57-72. 63. Marnewick J, Joubert E, Joseph S i wsp. Inhibition of tumour promotion in mouse skin by extracts of Rooibos (Aspalathus linearis) and honeybush (Cyclopia intermedia), unique South African herbal teas. Cancer Lett 2005; 224(2):193-202. 64. Schloms L, Storbeck KH, Swart P i wsp. The influence of Aspalathus linearis (Rooibos) and dihydrochalcones on adrenal steroidogenesis: Quantification of steroid intermediates and end products in H295R cells. J Steroid Biochem 2012; 128:128-38. 65. Schloms L, Swart A: Rooibos flavonoids inhibit the activity of key adrenal steroidogenic enzymes, modulating steroid hormone levels in H295R cells. Molecules 2014; 19(3):3681-95. 66. Schloms L, Smith C, Storbeck KH i wsp. Rooibos influences glucocorticoid levels and steroid ratios in vivo and in vitro: A natural approach in the management of stress and metabolic disorders? Mol Nutr Food Res 2014; 58(3):537-49. 67. Pantsi WG, Marnewick JL, Esterhuyse AJ i wsp. Rooibos (Aspalathus linearis) offers cardiac protection against ischaemia/reperfusion in the isolated perfused rat heart. Phytomed 2011; 18(14):1220-8. 68. Dludla PV, Muller CJF, Louw J i wsp. The cardioprotective effect of an aqueous extract of fermented Rooibos (Aspalathus linearis) on cultured cardiomyocytes derived from diabetic rats. Phytomed 2014; 21(5):595-601. 69. Villano D, Pecorari M, Testa MF i wsp. Unfermented and fermented Rooibos teas (Aspalathus linearis) increase plasma total antioxidant capacity in healthy humans. Food Chem 2010; 23:679-83. 70. Persson IAL, Persson K, Hägg S i wsp. Effects of green tea, black tea and Rooibos tea on angiotensin-converting enzyme and nitric oxide in healthy volunteers. Public Health Nutr 2010; 13(5):730-7. 71. Persson IAL: The pharmacological mechanism of angiotensin-converting enzyme inhibition by green tea, Rooibos and enalaprilat – a study on enzyme kinetics: mechanism of ace by tea and enalaprilat. Phytother Res 2012; 26(4):517-21. 72. Marnewick JL, Rautenbach F, Venter I i wsp. Effects of Rooibos (Aspalathus linearis) on oxidative stress and biochemical parameters in adults at risk for cardiovascular disease. J Ethnopharmacol 2011; 133(1):46-52. 73. Breet P, Kruger HS, Jerling JC i wsp. Actions of black tea and Rooibos on iron status of primary school children. Nutr Res 2005; 25:983-99. 74. Kunishiro K, Tai A, Yamamoto I. Effects of Rooibos tea extract on antigen-specific antibody production and cytokine generation in vitro and in vivo. Biosci Biotech Bioch 2001; 65(10):2137-45. 75. Khan A, Gilani AH. Selective bronchodilatory effect of Rooibos tea (Aspalathus linearis) and its flavonoid, chryzoeriol. Eur J Nutr 2006; 45(8):463-9. 76. Nash LA, Sullivan PJ, Peters SJ i wsp. Rooibos flavonoids, orientin and luteolin, stimulate mineralization in human osteoblasts through the Wnt pathway. Mol Nutr Food Res 2015; 59(3):443-53. 77. Ichiyama K, Tai A, Yamamoto I. Augmentation of antigen-specific antibody production and IL-10 generation with a fraction from Rooibos (Aspalathus linearis) tea. Biosci Biotech Bioch 2007; 71(2):598-602. 78. Gilani AH, Khan AU, Ghayur MN i wsp. Antispasmodic effects of Rooibos tea (Aspalathus linearis) is mediated predominantly through K+-channel activation. Basic Clin Pharmacol 2006; 99(5):365-73. 79. Kondo M, Hirano Y, Nishio M i wsp. Xanthine oxidase inhibitory activity and hypouricemic effect of aspalathin from unfermented Rooibos. J Food Sci 2013; 78(12):H1935-9. 80. Hesseling PB, Klopper JF, Van Heerden PDR. Die effek van Rooibostee op ysterabsorpsie. S Afr Med J 1979; 55(16):631-2. 81. Matsuda K, Nishimura Y, Kurata N i wsp. Effects of continuous ingestion of herbal teas on intestinal CYP3A in the rat. J Pharmacol Sci 2007; 103(2):214-21. 82. Hübsch Z, Van Vuuren SF, Van Zyl RL. Can Rooibos (Aspalathus linearis) tea have an effect on conventional antimicrobial therapies? S Afr J Bot 2014; 93:148-56.



