© Borgis - Postępy Fitoterapii 3/2016, s. 200-207
*Elżbieta Studzińska-Sroka1, Daria Zarabska-Bożejewicz2
Pustułka pęcherzykowata (Hypogymnia physodes (L.) Nyl.) – charakterystyka porostu i jego właściwości biologiczne
Hypogymnia physodes (L.) Nyl. – characteristic of the lichen and its biological properties
1Katedra i Zakład Farmakognozji, Uniwersytet Medyczny im. K. Marcinkowskiego w Poznaniu
Kierownik Zakładu: prof. dr hab. n. farm. Wiesława Bylka
2Instytut Środowiska Rolniczego i Leśnego, Polska Akademia Nauk w Poznaniu
Dyrektor Instytutu: prof. dr hab. n. farm. Lech W. Szajdak
Streszczenie
Pustułka pęcherzykowata (Hypogymnia physodes (L.) Nyl.) jest porostem z rodziny tarczownicowatych (Parmeliaceae), powszechnie występującym w różnych częściach Europy, w tym w Polsce oraz na innych kontynentach. Jako epifit porasta pnie i gałęzie drzew liściastych oraz iglastych. W wyniku swoistych relacji pomiędzy cudzożywnym grzybem a samożywnym fotobiontem – glonem lub sinicą, dochodzi do wytwarzania przez pierwszego z wymienionych wyżej partnerów metabolitów wtórnych, niespotykanych w świecie roślin, o interesujących, słabo poznanych właściwościach biologicznych. Związki, których obecność w plechach pustułki pęcherzykowatej potwierdzono, to: atranoryna, chloroatranoryna, kwas fyzodowy, kwas 3-hydroksyfyzodowy, kwas 2'-O-metylofyzodowy, kwas fyzodalowy, kwas protocetrarowy oraz kwas izofyzodowy. Prowadzone badania o charakterze in vitro wykazały, że związki i wyciągi z H. physodes wykazują wielokierunkowe właściwości biologiczne. Rezultaty eksperymentów świadczą o ich aktywności przeciwdrobnoustrojowej, antyoksydacyjnej, cytotoksycznej wobec komórek nowotworowych oraz hamującej aktywność enzymatyczną. Depsydony izolowane z pustułki pęcherzykowatej wpływały również na komórki układu odpornościowego. Ponadto porost ten jest często wykorzystywany w badaniach bioindykacyjnych i biomonitoringowych na potrzeby oceny stanu środowiska, w tym zanieczyszczenia powietrza m.in. metalami ciężkimi.
Summary
Hypogymnia physodes (L.) Nyl. is the lichenized fungus within the Parmeliaceae family, that commonly occurs both in Poland, and other parts of Europe as well as in many other parts of the world. It is the epiphytic lichen growing on trunks and branches of deciduous and coniferous trees. As a result of the specific relationship between a heterotrophic fungus and an autotrophic photobiont – algae or cyanobacteria among others some secondary compounds are produced by mycobiont, not found among plants and with interesting and little-known biological properties. Till now, the presence of: atranorin, chloroatranorin, physodic acid, 3-hydroxyphysodic acid, 2'-O-methylphysodic acid, physodalic acid, protocetraric acid and isophysodic acid, was confirmed in thallus of H. physodes. In vitro studies revealed interesting biological properties of compounds and extracts from H. physodes. Results of experiments proved their antibacterial and antioxidant activities, as well as cancer cell cytotoxicity and inhibitory effects on enzymes. Depsidones isolated from H. physodes also influenced on cells of the immune system. Moreover, this lichen is often used in bioindicator and biomonitoring studies that allow for assessment of environmental conditions, also air pollution with i.a. heavy metals.

Wstęp
Porosty (grzyby zlichenizowane) to organizmy, których plecha zbudowana jest z komórek autotroficznego komponentu zielonego (glonu lub sinicy) oraz cudzożywnego grzyba lichenizującego zwanego mikobiontem. Obaj partnerzy wchodzą w swoisty typ wzajemnej zależności o charakterze symbiozy. To dzięki zdolnościom fotosyntetycznym fotobionta możliwe jest wytwarzanie potrzebnych do wzrostu składników odżywczych, natomiast przemiany biochemiczne zachodzące w strzępkach mikobionta pozwalają na produkcję metabolitów wtórnych. Związki te zapewniają porostom m.in. ochronę przed wpływem niekorzystnych czynników zewnętrznych.
Do tej pory na terenie Polski stwierdzono występowanie ok. 1500 gatunków grzybów zlichenizowanych (1). Jednym z nich jest pospolita na obszarze całego kraju pustułka pęcherzykowata (Hypogymnia physodes (L.) Nyl.). Dotąd niewykorzystywana w lecznictwie, wzbudziła zainteresowanie naukowców, a rezultaty prowadzonych eksperymentów świadczą o interesujących właściwościach badanego porostu, w tym o jego aktywności biologicznej. Praca stanowi przegląd informacji na temat porostu H. physodes i obejmuje jego charakterystykę, opis właściwości biologicznych ekstraktów otrzymanych z plechy pustułki oraz obecnych w niej związków o charakterze metabolitów wtórnych, a także omówienie roli gatunku w analizach bioindykacyjnych.
Opis gatunku
Hypogymnia physodes jest gatunkiem powszechnie występującym w różnych częściach Europy, Ameryce Północnej, Afryce Wschodniej, a nawet w Himalajach (2, 3). Jako epifit porasta pnie i gałęzie drzew liściastych oraz iglastych. Jest gatunkiem kwasolubnym, dlatego szczególnie korzystne warunki dla swojego rozwoju znajduje na podłożach o niższym odczynie, np. na korze sosny, brzozy, świerka, dębu. Ponadto porost ten stwierdzany jest również na drewnie, słomianych dachach, rzadziej na piaszczystej glebie, humusie oraz na podłożu skalnym (3, 4).
Pustułka pęcherzykowata ma listkowatą, luźno przyczepioną do podłoża plechę o kształcie rozetkowatym lub nieregularnym, silnie podzieloną na odcinki, o rozmiarze dochodzącym najczęściej do 5 cm (5). Górna powierzchnia plechy jest gładka, szara lub szarozielona, na końcach odcinków brunatnawo nabiegła, natomiast dolna część jest silnie pomarszczona i ma kolor czarny, przechodzący na obwodzie w odcień jasnobrązowy. Pustułka pęcherzykowata nie ma chwytników, natomiast do podłoża przyczepiona jest za pomocą zmarszczek dolnej kory. Soralia, które stanowią skupienia sorediów (czyli wytworów na plesze składających się zwykle z kilku lub kilkunastu komórek glonów oplecionych strzępkami grzyba, służących namnażaniu się porostów), są typu paszczowatego i powstają wskutek pęknięcia plechy na granicy dolnej i górnej warstwy korowej na końcach odcinków (4). Owocniki, osiągające średnicę 2-8 mm, są bardzo rzadko obserwowane, natomiast zarodniki są jednokomórkowe, bezbarwne, elipsoidalne o wymiarach 6-9 x 4-5 μm (5).
Związki chemiczne
H. physodes wytwarza substancje chemiczne o charakterze depsydów i depsydonów. Do pierwszej grupy należą atranoryna i chloroatranoryna (obecne w części korowej plechy). Do grupy depsydonów zaliczane są: kwas fyzodowy, kwas 3-hydroksyfyzodowy, kwas 2'-O-metylofyzodowy, kwas fyzodalowy oraz kwas protocetrarowy (w części rdzeniowej). Ponadto z plechy wyizolowano kwas izofyzodowy (2, 6-10) (ryc. 1).
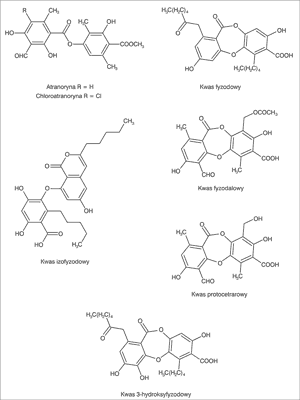
Ryc. 1. Wzory związków obecnych w H. physodes
Wykonane analizy HPLC określające zawartość związków w plesze H. physodes zebranej na terenie Skandynawii (Norwegia) wykazały, że wśród obecnych w poroście metabolitów wtórnych, najwyższe stężenie charakteryzowało kwas fyzodalowy (2,7-8,4% suchej masy) i fyzodowy (3,3-5,0%), natomiast kwas protocetrarowy, a także substancje zawarte w części korowej: atranoryna i chloroatranoryna były obecne w znacznie mniejszej ilości (odpowiednio 0,26-0,52%; 0,14-0,43%; 0,03-0,18%) (8).
Badano również całkowitą zawartość polifenoli oraz flawonoidów w ekstraktach otrzymanych z plech H. physodes. Wyciąg metanolowy, uzyskany drogą 24-godzinnej maceracji w temp. pokojowej, charakteryzowała wysoka zawartość polifenoli (141,59 mg kwasu galusowego/g wyciągu) oraz znacznie niższa flawonoidów (20,14 mg rutyny/g wyciągu) (10). W innym badaniu zawartość polifenoli dla ekstraktów acetonowego, metanolowego oraz wodnego wynosiła odpowiednio 30,1; 86,8 i 6,3 μg równoważnika pirokatecholu. Ilość flawonoidów była porównywalna dla ekstraktów acetonowego i metanolowego (30,1 i 32,1 μg równoważnika rutyny) oraz znacznie niższa dla ekstraktu wodnego (11,3 μg równoważnika rutyny) (11).
Metabolity wtórne a czynniki środowiskowe
Ilość metabolitów wtórnych, obecnych w plesze pustułki pęcherzykowatej, może ulegać zmianom wskutek działania różnorodnych czynników środowiskowych, w tym powiązanych z działalnością antropogeniczną. Zmiany te mogą przejawiać się wzrostem lub obniżeniem zawartości substancji porostowych (12). Solhaug i wsp. (8) przeprowadzili ilościową analizę stężenia metabolitów wtórnych w plechach H. physodes rosnących na stanowiskach o odmiennym stopniu nasłonecznienia. Zwiększenie całkowitej zawartości metabolitów wtórnych w badanym poroście powiązane było ze wzrostem nasłonecznienia. Ponadto wykazano dodatnie zależności pomiędzy ilością atranoryny i chloroatranoryny a bezpośrednim i rozproszonym promieniowaniem. W przypadku kwasów: fyzodowego, fyzodalowego i protocetrarowego wykryto lepsze korelacje ich zawartości z promieniowaniem słonecznym w porównaniu z promieniowaniem bezpośrednim (8).
Wpływ metali ciężkich na wytwarzanie metabolitów wtórnych u H. physodes oceniano u transplantów eksponowanych przez 6 mies. na stanowiskach zlokalizowanych na terenie Krakowskiego Okręgu Przemysłowego (12). Największą zawartość Cd, Pb i Zn stwierdzono w plechach zebranych w pobliżu huty cynku i ołowiu, podczas gdy Cr i Ni – w sąsiedztwie zakładu chemicznego produkującego związki chromu, fosforu i siarki. Bliskość zakładu przemysłowego wpłynęła na zmniejszenie ilości kwasów fyzodowego i hydroksyfyzodowego oraz atranoryny u transplantów. Podobne wyniki uzyskali Hauck i wsp. (13), którzy wykryli m.in. dodatnie korelacje pomiędzy zawartością kwasu fyzodalowego u H. physodes a wzrostem Cu2+ i Mn2+ w substracie, przy zmniejszaniu się ilości kwasu 3-hydroksyfyzodowego. Udowodniono, że związki o charakterze depsydonów, występujące w plesze H. physodes, mogą wykazywać zdolność wiązania kationów niektórych metali (14). Według danych piśmiennictwa kwas fyzodalowy wykazywał niezwykle silną (95%) zdolność adsorbowania jonów metali Fe3+. Właściwość tę miały również kwasy fyzodowe i protocetrarowy, jednak w stopniu znacznie niższym od wymienionego wyżej związku (odpowiednio ok. 44 i 43%). Zjawiska nie zaobserwowano dla jonów Fe2+. Zdolność adsorpcji kationów metali, jednak już w dużo mniejszym stopniu, dotyczyła także jonów Ca2+ i Mg2+.
Zwiększoną ilość kwasu fyzodalowego w plechach wskutek ekspozycji na metale ciężkie można traktować jako przejaw funkcji tego związku w kształtowaniu strategii obronnej u H. physodes względem kumulujących się zanieczyszczeń (12-14). Wskazana wyżej właściwość może posłużyć wyjaśnieniu procesu wolniejszego ustępowania pustułki pęcherzykowatej wskutek zanieczyszczenia środowiska w porównaniu z innymi przedstawicielami tego rodzaju, tj. H. farinacea, H. tubulosa i H. vittata, czyli gatunkami, które nie mają w swojej plesze kwasu fyzodalowego (14). Dane prezentowane w piśmiennictwie przedmiotu przemawiają za możliwością wykorzystania metabolitów wtórnych jako biomarkerów w badaniach środowiskowych (12).
Znane jest także oddziaływanie substancji porostowych na inne elementy biotyczne obecne w ekosystemach. Zdaniem Latkowskiej i wsp. (15) metabolity wtórne u pustułki pęcherzykowatej przyczyniły się do obniżenia żywotności świerku Picea abies i usychania jego gałęzi porośniętych obficie plechami porostu. Stwierdzenie to oparto na wynikach wskazujących na obecność kwasu fyzodalowego, 3-hydroksyfyzodowego oraz atranoryny w korze drzewa w miejscach bezpośrednio zasiedlonych przez porost (16). Ekstrakt acetonowy z H. physodes hamował rozwój grzybów chorobotwórczych tj. Pythium ultimum, Ustilago maydis i Phytophthora infestans (17). Sugeruje to, że metabolity wtórne inne niż atranoryna, znajdujące się u pustułki pęcherzykowatej, także hamują wzrost wymienionych powyżej grzybów (17).
Aktywność biologiczna
Działanie przeciwdrobnoustrojowe
Przeciwbakteryjne działanie ekstraktów otrzymanych z porostów oraz izolowanych z nich tzw. kwasów porostowych jest testowane od dawna. Mitrović i wsp. (10) badali ekstrakt metanolowy z H. physodes na 29 szczepach drobnoustrojów. W zależności od grupy testowanych drobnoustrojów aktywność znacznie różniła się. Ekstrakt wykazywał zróżnicowaną aktywność wobec Bacillus sp. (MIC = 0,04-0,08 mg/ml), Enterococcus faecalis (MIC = 0,08-5,0 mg/ml), Staphylococcus aureus (MIC = 0,04-0,3 mg/ml) i Pseudomonas aeruginosa (MIC = 6,3 mg/ml). Ekstrakty metanolowe z H. physodes działały również przeciwgrzybiczo. Ekstrakt metanolowy z H. physodes wykazywał dość wysoką aktywność wobec szczepu wzorcowego Aspergillus niger (MIC = 0,01 mg/ml), przy czym aktywność wobec szczepu klinicznego A. niger była znacznie niższa (MIC = 5,0 mg/ml). Wykazane w badaniach minimalne stężenie hamujące rozwój innych grzybów pleśniowych i drożdżoidalnych wahało się dla omawianych wyciągów od 0,63 do 10 mg/ml. Aktywność flukonazolu wahała się w odniesieniu do badanych grzybów w granicach MIC = 0,03-0,5 mg/ml.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Fałtynowicz W. The lichens, lichenicolous and allied fungi of Poland. An annotated checklist. Krytyczna lista porostów i grzybów naporostowych Polski. W Szafer Institute of Botany, Polish Academy of Sciences, Kraków 2003. 2. Purvis OW, Coppins BJ, Hawksworth DL i wsp. (eds.). The lichen flora of Great Britain and Ireland. Natural History Publications, London 1992. 3. Fałtynowicz W. Porosty w lasach. Przewodnik terenowy dla leśników i taksatorów. Cent Inform Lasów Państw, Warszawa 2012. 4. Fałtynowicz W. Porosty jako biowskaźniki zmian w środowisku Karkonoszy. Materiały edukacyjne Karkonoskiego Parku Narodowego. Karkonoski Park Narodowy, Jelenia Góra 2014. 5. Tobolewski Z. Porosty. Klucz do oznaczania gatunków krajowych. PWN, Warszawa 1972. 6. Culberson CF. Chemical and botanical guide to lichen products. The University of North Carolina Press, Chapel Hill 1969. 7. Huneck S, Yoshimura I. Identification of lichen substances. Springer-Verlag Berlin-Heidelberg 1996. 8. Solhaug KA, Lind M, Nybakken L i wsp. Possible functional roles of cortical depsides and medullary depsidones in the foliose lichen Hypogymnia physodes. Flora 2009; 204:40-8. 9. Pavlovic V, Stojanovic I, Jadranin M i wsp. Effect of four lichen acids isolated from Hypogymnia physodes on viability of rat thymocytes. Food Chem Toxicol 2013; 51:160-4. 10. Mitrović T, Stamenković S, Cvetković V i wsp. Antioxidant, antimicrobial and antiproliferative activities of five lichen species. Int J Mol Sci 2011; 12(8):5428-48. 11. Kosanić M, Ranković B, Vukojević J. Antioxidant properties of some lichen species. J Food Sci Technol 2011; 48(5):584-90. 12. Białońska D, Dayan FE. Chemistry of the lichen Hypogymnia physodes transplanted to an industrial region. J Chem Ecol 2005; 31:2975-91. 13. Hauck M, Böning J, Jacob M i wsp. Lichen substance concentrations in the lichen Hypogymnia physodes are correlated with heavy metal concentrations in the substratum. Environ Exper Bot 2013; 85:58-63. 14. Hauck M, Huneck S. Lichen substances affect metal adsorption in Hypogymnia physodes. J Chem Ecol 2007; 33:219-23. 15. Latkowska E, Chrapusta E, Bober B i wsp. Allelopathic effects of epiphytic lichen Hypogymnia physodes (L.) Nyl. colonization on the spruce (Picea abies (L.) Karst.) bark. Allelopathy J 2015; 35(1):129-38. 16. Latkowska E, Bober B, Chrapusta E i wsp. Secondary metabolites of the lichens Hypogymnia physodes (L.) Nyl. and their presence in spruce (Picea abies (L.) H. Karst.) bark. Phytochem 2015; 118:116-23. 17. Halama P, Van Haluwin Ch. Antifungal activity of lichen extracts and lichenic acids. BioControl 2004; 49:95-107. 18. Gollapudi SR, Telikepalli H, Jampani HB i wsp. Alectosarmentin, a new antimicrobial dibenzofuranoid lactol from the lichen, Alectoria sarmentosa. J Nat Prod 1994; 57(7):934-8. 19. Türk H, Yilmaz M, Tay T i wsp. Antimicrobial activity of extracts of chemical races of the lichen Pseudevernia furfuracea and their physodic acid, chloroatranorin, atranorin and olivetoric acid constituents. Z Naturforsch [C] 2006; 61c:499-507. 20. Ranković B, Mišić M, Sukdolak S. The antimicrobial activity of substances derived from the lichens Physcia aipola, Umbilicaria polyphylla, Parmelia caperata and Hypogymnia physodes. World J Microbiol Biotechnol 2008; 24:1239-42. 21. Yilmaz M, Tay T, Kivanç M i wsp. The antimicrobial activity of extracts of the lichen Hypogymnia tubulosa and its 3-hydroxyphysodic acid constituent. Z Naturforsch [C] 2005; 60(1-2):35-8. 22. Ahmadjian V, Hale ME (eds.). The Lichens. Academic Press. New York, San Francisco, London 1973. 23. Stojanović G, Stojanović I, Stankov-Jovanović V i wsp. Reducing power and radical scavenging activity of four Parmeliaceae species. Centr Eur J Biol 2010; 5(6):808-13. 24. Ranković B, Kosanić M, Manojlović N i wsp. Chemical composition of Hypogymnia physodes lichen and biological activities of some its major metabolites. Med Chem Res 2014; 23(1):408-16. 25. Türkez H, Aydin E, Aslan A. Effects of lichenic extracts (Hypogymnia physodes, Ramalina polymorpha and Usnea florida) on human blood cells: cytogenetic and biochemical study. Iran J Pharm Res 2012; 11(3):889-96. 26. Müller K. Pharmaceutically relevant metabolites from lichens. Appl Microbiol Biotechnol 2001; 56:9-16. 27. Neamati N, Hong H, Mazumder A i wsp. Depsides and depsidones as inhibitors of HIV-1 integrase: Discovery of Novel Inhibitors through 3D Database Searching. J Med Chem 1997; 40:942-51. 28. Proksa B, Adamcová J, Sturdíková M i wsp. Metabolites of Pseudevernia furfuracea (L.) Zopf. and their inhibition potential of proteolytic enzymes. Pharmazie 1994; 49(4):282-3. 29. Ari F, Celikler S, Oran S i wsp. Genotoxic, cytotoxic, and apoptotic effects of Hypogymnia physodes (L.) Nyl. on breast cancer cells. Environ Toxicol 2014; 29(7):804-13. 30. Kosanić M, Ranković B, Stanojković T. Investigation of selected Serbian lichens for antioxidant, antimicrobial and anticancer properties. JAPS 2013; 23(6):1628-33. 31. Shibamoto T, Wei CI. Mutagenicity of lichen constituents. Environ Mutagen 1984; 6(5):757-62. 32. Osawa T, Kumon H, Reece CA i wsp. Inhibitory effect of lichen constituents on mutagenicity induced by heterocyclic amines. Environ Mol Mutagen 1991; 18(1):35-40. 33. Matwiejuk A. Porosty Białegostoku jako wskaźniki zanieczyszczenia atmosfery. T. II. Wyd Ekonomia i Środowisko, Białystok 2007. 34. Jóźwiak MA, Jóźwiak M, Szwed M. Metody transplantacji porostów stosowane w biomonitoringu powietrza atmosferycznego. NEM 2010; 11:15-23. 35. Jóźwiak M. Kumulacja metali ciężkich i zmiany morfologiczne w plechach porostu Hypogymnia physodes (L.) Nyl. NEM 2007; 8:51-6. 36. Jóźwiak MA, Jóźwiak M. Influence of cement industry on accumulation of heavy metals in bioindicators. Ecol Chem Eng S 2009; 16(3):323-34. 37. Kłos A. Porosty w biomonitoringu środowiska. Uniwersytet Opolski, Studia i Monografie nr 420, Opole 2009. 38. Hauck M, Runge M. Stemflow chemistry and epiphytic lichen diversity in dieback-affected spruce forest of the Harz Mountains, Germany. Flora 2002; 197:250-61.

