*Halina Ekiert1, Agnieszka Sondej1, Marta Klimek-Szczykutowicz1, Radosław J. Ekiert2, Agnieszka Szopa1
Nowe surowce roślinne w Farmakopei Europejskiej. Część I. Gatunki rodzaju Bupleurum (przewiercień) – źródło nowego surowca saponinowego
The new plant raw materials in the European Pharmacopoeia. Part 1. Species from Bupleurum genus – new saponin raw material
1Katedra i Zakład Botaniki Farmaceutycznej, Wydział Farmaceutyczny, Uniwersytet Jagielloński – Collegium Medicum, Kraków
Kierownik Katedry i Zakładu: prof. dr hab. n. farm. Halina Ekiert
2KZZ Herbapol SA w Krakowie
Streszczenie
Jeden z ostatnich suplementów do Farmakopei Europejskiej (Supl. 9.4) wprowadza kilka nowych roślinnych surowców leczniczych, dotychczas nieznanych i niewykorzystywanych w oficjalnym lecznictwie europejskim. W artykule scharakteryzowano gatunki roślin z rodzaju Bupleurum (Przewiercień), dostarczające nowego surowca saponinowego. Przedstawiono charakterystykę botaniczno-ekologiczną oraz aktualny stan badań dotyczący chemizmu farmakopealnych gatunków z tego rodzaju. Szczegółowo przedstawiono zastosowania terapeutyczne surowca – Bupleuri radix, potwierdzone badaniami naukowymi. Zwrócono uwagę na pozycję tego surowca w tradycyjnej chińskiej medycynie (TCM). Podkreślono, że od ok. 20 lat surowiec ma monografię World Health Organization (WHO). Ponadto zasygnalizowano znaczenie omawianych roślin w przemyśle spożywczym oraz rosnącą ich pozycję w przemyśle kosmetycznym. Celem publikacji jest popularyzacja podstawowej wiedzy dotyczącej farmakopealnych gatunków rodzaju Bupleurum w polskim środowisku farmaceutycznym, lekarskim i fitoterapeutycznym.
Summary
One of the last supplements to the European Pharmacopoeia (Supl. 9.4) introduces several new herbal medicinal raw materials, so far unknown and not used in official Central European phytotherapy. The article describes plant species from Bupleurum genus providing new saponin raw material. The botanical and ecological characteristics as well as the current state of research on the chemistry of pharmacopoeial species from that genus were presented. The confirmed by scientific researches therapeutic applications of plant raw material – Bupleuri radix, were described particularly. Attention was paid to the position of that raw material in Traditional Chinese Medicine (TCM). It was emphasized that for about 20 years, it has had the World Health Organization (WHO) monograph. In addition, the importance of this plant in the food industry and its increasing status in the cosmetic industry were pointed. The aim of the article is the popularization of basic knowledge about pharmacopoeial species from Bupleurum genus in the Polish pharmaceutical, medical and phytotherapeutical environment.

Wstęp
W ostatnim 10-leciu można zaobserwować znaczny wzrost liczby roślin wprowadzonych do lecznictwa zarówno w Europie, jak i w Polsce. Największa liczba nowych gatunków roślin leczniczych pochodzi z obszaru Azji Południowo-Wschodniej i wynika ze wskazań tradycyjnej medycyny dalekowschodniej, głównie chińskiej i koreańskiej. Liczne nowe gatunki pochodzą także z obszaru Ameryki Południowej i wynikają ze wskazań tradycyjnej medycyny południowoamerykańskiej.
Jeden z najnowszych dokumentów farmakopealnych – Suplement 9.4 do Farmakopoei Europejskiej (nieprzetłumaczony jeszcze na język polski) (1) wprowadza nieznane dotychczas w lecznictwie europejskim gatunki pochodzące z Azji Południowo-Wschodniej, które od dawna znane są w tradycyjnej chińskiej medycynie (TCM): Bupleurum chinense DC. – przewiercień chiński i gatunek równocenny – Bupleurum scorzonerifolium Willd. (Apiaceae), a także Platycodon grandiflorus (Jacq.) A. DC. – rozwar wielkokwiatowy (Campanulaceae), Ligusticum sinense Oliv. – lubczyk chiński (Apiaceae), Houttuynia cordata Thunb. – pstrolistka sercowata (Saururaceae) oraz Paeonia × suffruticosa Andrews – piwonia drzewiasta (Paeoniaceae). Pierwsze trzy gatunki dostarczają nowych surowców saponinowych, kolejne surowca olejkowego, flawonoidowego i terpenowego. Nowymi roślinami farmakopealnymi zgodnie z wymienionym Suplementem są także rośliny o utrwalonej pozycji w lecznictwie ogólnoświatowym, które nie były dotychczas roślinami farmakopealnymi w Europie, m.in.: dwa gatunki południowoamerykańskie – Paullinia cupana Kunth – Paullinia guarana (Sapindaceae), Ilex paraguariensis A.St.-Hil. (Mate) – ostrokrzew paragwajski (Aquifoliaceae) oraz azjatycki gatunek – Camellia sinensis (L.) Kuntze – herbata chińska (Theaceae) (1).
Na początek zdecydowano scharakteryzować gatunki roślin z rodzaju Bupleurum, dostarczające nowego surowca saponinowego. Następnie zaplanowano zaprezentować inny wschodnioazjatycki gatunek – Platycodon grandiflorus, a w kolejnych artykułach: Ligusticum sinense, Houttuynia cordata i Paeonia × suffruticosa. Dalsze publikacje poświęcone będą innym znanym gatunkom roślin wprowadzonym przez Suplement 9.4 do oficjalnego lecznictwa europejskiego: Paullinia cupana, Ilex paraguariensis oraz Camellia sinensis.
Celem zaplanowanej serii artykułów jest popularyzacja podstawowej wiedzy dotyczącej nowych farmakopealnych gatunków i możliwych zastosowań terapeutycznych pozyskiwanych z nich surowców zarówno w środowisku farmaceutów i lekarzy, jak i fitoterapeutów.
Bupleurum sp. (przewiercień) –
gatunki farmakopealne
Bupleuri radix jako surowiec roślinny znany w tradycyjnej chińskiej medycynie (TCM) jest szeroko stosowany w Chinach, Japonii, Korei i innych krajach azjatyckich w leczeniu grypy, gorączki, stanów zapalnych, malarii, zaburzeń miesiączkowania, zapalenia wątroby i chorób przewodu pokarmowego. Surowiec wchodzi także w skład wielu preparatów złożonych (2).
We współczesnych dokumentach farmakopealnych monografia Bupleuri radix figuruje w Farmakopei Chińskiej i Japońskiej (3-4). Surowiec ten ma również od 1999 roku monografię World Health Organization (WHO) (5).
Informacje ogólne
Rodzaj Bupleurum (Apiaceae – Selerowate) obejmuje około 180-190 gatunków powszechnie występujących na półkuli północnej, w Europie i Azji, a także w Ameryce Północnej i północnej Afryce, gdzie są stosowane ze względu na właściwości lecznicze. B. chinense i B. scorzonerifolium występują na stanowiskach naturalnych i są powszechnie uprawiane w krajach Azji Wschodniej, tj. w Chinach, Japonii i Korei. W Chinach podaż na surowiec Bupleurum radix sięga rocznie około 8 milionów kilogramów. Kilka gatunków Bupleurum występuje również w Polsce – w tym B. falcatum. Niektóre z nich są objęte ochroną i figurują w „Polskiej czerwonej księdze roślin” (2, 6-8).
Zagadnienia taksonomiczne
Monografia „Bupleurum root” – korzenia przewiercienia pojawiła się po raz pierwszy w Suplemencie 9.4 do European Pharmacopoeia 9th. Suplement dopuszcza do pozyskiwania tego surowca dwa gatunki: Bupleurum chinense DC. (przewiercień chiński) oraz Bupleurum scorzonerifolium Willd. Surowcem farmaceutycznym są wysuszone, całe lub połamane korzenie B. chinense lub B. scorzonerifolium. Surowiec standaryzowany jest na zawartość saikosaponiny A (ryc. 1), której zawartość nie może być mniejsza niż 0,16% (9).
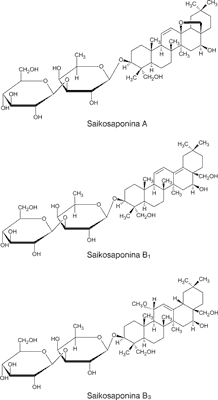
Ryc. 1. Struktura chemiczna saikosaponin A, B1 i B3
Monografia WHO wskazuje, że B. chinense DC. i B. scorzonerifolium Willd. są traktowane jako synonimy B. falcatum L. var. scorzonerifolium Willd. (5), jednakże w niektórych źródłach, a także w badaniach eksperymentalnych są traktowane jako odrębne gatunki (6, 10).
W niniejszym opracowaniu zebrano informacje o gatunkach opisywanych jako B. chinense DC., B. scorzonerifolium Willd. oraz B. falcatum L.
Wymienione gatunki występują pod licznymi nazwami synonimowymi. B. chinense w piśmiennictwie naukowym określany jest jako: B. vanheurckii Müll. Arg., B. togasii Kitag., B. pekinense f. chiliosciadium (H. Wolff) Hemsl., B. pekinense Franch. ex Hemsl., B. octoradiatum Bunge, oraz B. falcatum var. chiliosciadium H. Wolff (11). Z kolei B. scorzonerifolium pojawia się pod następującymi nazwami: B. falcatum var. longipedunculatum H. Boissieu, B. falcatum var. scorzonerifolium (Willd.) Ledeb., B. sinensium Gand., B. stenophyllum (Nakai) Kitag. oraz B. falcatum subsp. scorzonerifolium (Willd.) Koso-Pol. (12).
Surowiec znany jest jako: chaihu (dla B. chinense; j. chiń.), Bei Chai Hu, saiko (dla B. falcatum; j. chiń.), bupleurum, thorow-wax (j. ang.) (5, 13). Najważniejsza z nich to chińska nazwa „saiko”; od niej biorą nazwę główne związki aktywne surowca – saikosaponiny.
Charakterystyka botaniczno-ekologiczna
Bupleurum chinense DC. jest wieloletnią rośliną zielną, osiągającą wysokość 50-85 cm. Korzeń tego gatunku jest szarobrązowy, stożkowaty, o długości 6-20 cm. Liście są pojedyncze, ułożone naprzemianlegle, o kształcie liniowolancetowatym z zaostrzonym wierzchołkiem, o wymiarach 4-7 × 0,6-0,8 cm. Kwiaty liczą po 5 jasnożółtych płatków korony i są zebrane w baldach złożony. Owoce są podłużne, brązowe. Osiągają ok. 3 mm długości. Roślina kwitnie od lipca do września. Owocuje od sierpnia do października. B. chinense w środowisku naturalnym rośnie na obszarach trawiastych, brzegach rzek, słonecznych stokach i na poboczach dróg oraz w innych miejscach na wysokości od 100 do 2700 m n.p.m.
Bupleurum scorzonerifolium Willd. dorasta do wysokości 30-60 cm. Korzeń ma długość 4-10 cm oraz czerwonawobrązowy kolor. Liście osiągają wymiary 6-16 × 0,2-0,7 cm. Kwiaty mają po 5 płatków korony. Owoce są elipsoidalne, ciemnobrązowe o długości 2-3 mm. Roślina kwitnie od lipca do sierpnia. Owocuje od sierpnia do października. Gatunek ten rośnie na skraju lasów, na słonecznych stokach górskich, suchych obszarach trawiastych i w innych miejscach na wysokości od 200 do 3000 m n.p.m.
Bupleurum falcatum L. to bylina osiągająca wysokość do 80 cm. Liście tego gatunku są eliptyczne o długości 5-10 cm i szerokości 5-10 mm. Kwiaty zebrane są w 6-10 baldaszków. Owoc jest gładki, z nitkowatymi żeberkami. Gatunek ten w stanie naturalnym występuje na suchych zboczach i skałach wapiennych. Kwitnie od lipca do października. Jest charakterystyczny dla kserotermicznych zbiorowisk okrajkowych na siedliskach ciepłolubnych dąbrów (Geranion sanguinei) (2, 8).
Skład chemiczny
W ciągu ostatnich lat z Bupleuri radix wyizolowano około 74 związki. Za główne składniki aktywne biologicznie uznaje się saponiny triterpenowe – saikosaponiny (tab. 1). W surowcu występują także flawonoidy, poliacetyleny, lignany, olejek eteryczny, sacharydy, sterole i kwasy tłuszczowe. Saikosaponiny wykazują szerokie spektrum efektów biologicznych i farmakologicznych, w tym działanie przeciwzapalne, przeciwnowotworowe, immunomodulujące, przeciwwirusowe, przeciwbakteryjne, przeciwgorączkowe i hepatoochronne. Z surowca wyizolowano około 35 saponin. Wśród nich saikosaponiny A, B1, B3, C i D są głównymi związkami bioaktywnymi występującymi w surowcu (ryc. 1). Ważną grupę stanowią także polisacharydy pektynowe, w tym głównie bupleuran IIb (2).
Tab. 1. Główne grupy związków chemicznych występujące w Bupleuri radix
| Grupa związków, przykłady | Piśmiennictwo |
Saponiny triterpenowe:
saikosaponina A, B1, B2, B3, B4, C, D, E, F; 6”-O-malonylo-saikosaponina A, 6”-O-malonylosaikosaponina D,
2”-O-acetylosaikosaponina A, 3”-O-acetylosaikosaponina A, 4”-0- acetylosaikosaponina A ,
6”-O-acetylosaikosaponina A, 23-O-acetylosaikosaponina A, 2”-O-acetylosaikosaponina D,
3”-O-acetylosaikosaponina D, 4”-O-acetylosaikosaponina D, 6”-O-acetylosaikosaponina D, hydroksysaikosaponina A, hydroksysaikosaponina C, prosaikogenina G, prosaikogenina F, prosaikogenina D | (14-18) |
Flawonoidy:
eugenina, saikochromon A, saikochromozyd A, saikoizoflawonozyd A | (19-22) |
Poliacetyleny:
saikodiyny A, C; 2Z-9Z-pentadekadien-4,6-diyn-1-ol, (2Z,8Z,10E)-pentadekatrien-4,6-diyn-1-ol, (2Z,8E,10E)-pentadekatrien-4,6-diyn-1-ol, (2Z,8Z,10E)- heptadekatrien-4,6-diyn-1-ol, bupleurynol | (23-24) |
Lignany:
nortrachelogenina, nemerozyna, kaerofilina, izochaihulakton, izokaerofilina, (–)-yateina, chinensinaftol, chaihunafton | (2) |
Olejek eteryczny:
heksanal (29,5%), furfural (7,3%), kwas heksanowy (7,4%), 2-amylofuran (5,5%), (E,E)-2,4-dekadienal (5,9%) | (2-28) |
Sacharydy:
monosacharydy: rybitol, ksyloza, arabinoza polisacharydy pektynowe: bupleuran IIb, bupleuran IIc | (25) |
Sterole:
α-spinasterol, Δ7-stigmastenol, Δ22-stigmastenol | (26) |
Kwasy tłuszczowe:
kwas palmitynowy, kwas palmitooleinowy, kwas oleinowy, kwas linolowy | (27) |
Bupleuri radix – działanie biologiczne
Działanie przeciwzapalne
Za działanie przeciwzapalne surowca odpowiedzialne są głównie: saiksaponina A, saikosaponina C i saikogenina D. Korzeń od dawna jest stosowany w TCM w terapii różnorodnych chorób o podłożu zapalnym.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. European Pharmacopoeia, 9th Ed., Suplement 9.4 Council of Europe; Strasbourg 2017.
2. Yang F, Dong X, Yin X i wsp. Radix Bupleuri: A review of traditional uses, botany, phytochemistry, pharmacology, and toxicology. Biomed Res Int 2017; 7597596.
3. World Health Organization. Regional Office for the Western Pacific. Medicinal plants in China: a selection of 150 commonly used species. WHO Regional Office for the Western Pacific, Manila 1989.
4. World Health Organization. Regional Office for the Western Pacific. Medicinal Plants in the Republic of Korea: Information on 150 commonly used medicinal plants. WHO Regional Office for the Western Pacific, Manila 1998.
5. Radix Bupleuri. W: WHO Monographs on Selected Medicinal Plants. Geneva: World Health Organization 1999; 67-76.
6. Ashour ML, Wink M. Genus Bupleurum: a review of its phytochemistry, pharmacology and modes of action. J Pharm Pharmacol 2011; 63:305-21.
7. Zhu Z, Liang Z, Han R: Saikosaponin accumulation and antioxidative protection in drought-stressed. Environ Exp Bot 2009; 66:326-33.
8. Zarzycki K, Kaźmierczakowa R, Mirek Z. Polska czerwona księga roślin. Paprotniki i rośliny kwiatowe. Wyd. III. Uaktualnione i rozszerzone. Instytut Ochrony Przyrody PAN, Kraków 2014.
9. Yang Z-Y, Chao Z, Huo K-K i wsp. ITS sequence analysis used for molecular identification of the Bupleurum species from northwestern China. Phytomed 2007; 14(6):416-23.
10. She M, Pu F, Pan i wsp. Apiaceae through Ericaceae. Flora of China 2005; 14:70.
11. The Plant List. Bupleurum chinense (Online). http://www.theplantlist.org/tpl1.1/record/kew-2686488.
12. The Plant List. Bupleurum scorzonerifolium (Online). http://www.theplantlist.org/tpl1.1/record/kew-2687135.
13. van Wyk B, Wink M: Bupleurum falcatum. W: Rośliny lecznicze świata. MedPharm 2004; 73.
14. Ebata N, Nakajima K, Hayashi K i wsp.: Saponins from the root of Bupleurum falcatum. Phytochem 1996; 41:895-901.
15. Ding JK, Fujino H, Kasai R i wsp. Chemical evaluation of Bupleurum species collected in Yunnan, China. Chem Pharm Bull 1986; 34:1158-67.
16. Ishii H, Nakamura M, Seo S i wsp. Isolation, characterization, and nuclear magnetic resonance spectra of new saponins from the roots of Bupleurum falcatum L. Chem Pharm Bull 1980; 28:2367-73.
17. Shmitzu K, Amagaya S, Ogihara Y. New derivatives of saikosaponins. Chem Pharm Bull 1985; 33:3349-55.
18. Zhao YY, Luo HS, Wang B i wsp. Triterpenoid saponins from Bupleurum smithii var. parvifolium. Phytochem 1996; 42:1673-5.
19. Chang WL, Chiu LW, Lai JH i wsp. Immunosuppressive flavones and lignans from Bupleurum scorzonerifolium. Phytochem 2003; 64:1375-9.
20. Kobayashi M, Tawara T, Tsuchida T i wsp. Studies on the constituents of Umbelliferae plants. XVIII. Minor constituents of Bupleuri radix: Occurrence of saikogenins, polyhydroxysterols, a trihydroxy C18 fatty acid, a lignan and a new chromone. Chem Pharm Bull 1990; 38:3169-71.
21. Liang H, Zhao YY, Zhang RY. A new chromone glycoside from Bupleurum chinense. Chin Chem Lett 1998; 9:69-70.
22. Tan L, Zhao YY, Wang B i wsp. New isoflavonoside from Bupleurum scorzonerifolium. Chin Chem Lett 1998; 9:71-3.
23. Morita M, Nakajima K, Ikeya Y i wsp. Polyacetylenes from roots of Bupleurum falcatum. Phytochem 1991; 30:1543-5.
24. Liu J, Yuan F, Yang L i wsp. A qualitative, and quantitative determination and pharmacokinetic study of four polyacetylenes from Radix Bupleuri by UPLC-PDA–MS. J Pharm Biomed Anal 2015; 111:257-65.
25. Matsumoto T, Moriya M, Sakurai MH i wsp. Stimulatory effect of a pectic polysaccharide from a medicinal herb, the roots of Bupleurum falcatum L., on G-CSF secretion from intestinal epithelial cells. Int Immunopharmacol 2008; 8:581-8.
26. Takeda K, Kubota T. Studies on the steroidal components of domestic plants. XVIII. Components of the root of Bupleurum falcatum L. Chem Pharm Bull 1958; 6:536-9.
27. Li XQ, Song AH, Li XW i wsp. Analysis of the fatty acid from Bupleurum chinense DC. in China by GC-MS and GC-FID. Chem Pharm Bull 2005; 12:1613-7.
28. Li XQ, He ZG, Bi KS i wsp. Essential oil analyses of the root oils of 10 Bupleurum species from China. J Essent Oil Res 2007; 19(3):234-8.
29. Kodama Y, Xiaochuan L, Tsuchiya C i wsp. Dual effect of saikogenin D: in vitro inhibition of prostaglandin E2 production and elevation of intracellular free Ca2+ concentration in C6 rat glioma cells. Planta Med 2003; 69:765-7.
30. Zhu J, Luo C, Wang P i wsp. Saikosaponin A mediates the inflammatory response by inhibiting the MAPK and NF-κB pathways in LPS-stimulated RAW 264.7 cells. Exp Ther Med 2013; 5:1345-50.
31. Fu Y, Hu X, Cao Y i wsp. Saikosaponin a inhibits lipopolysaccharide-oxidative stress and inflammation in human umbilical vein endothelial cells via preventing TLR4 translocation into lipid rafts. Free Radic Biol Med 2015; 89:777-85.
32. Zhao H, Li S, Zhang H i wsp. Saikosaponin a protects against experimental sepsis via inhibition of NOD2-mediated NF-κB activation. Exp Ther Med 2015; 10:823-7.
33. Lee TH, Chang J, Kim BM. Saikosaponin C inhibits lipopolysaccharide-induced apoptosis by suppressing caspase-3 activation and subsequent degradation of focal adhesion kinase in human umbilical vein endothelial cells. Biochem Biophys Res Commun 2014; 445:615-21.
34. Xiea J, Di H-J, Li H i wsp. Bupleurum chinense DC. polysaccharides attenuates lipopolysaccharide-induced acute lung injury in mice. Phytomed 2012; 19:130-7.
35. Park WH, Kang S, Piao Y i wsp. Ethanol extract of Bupleurum falcatum and saikosaponins inhibit neuroinflammation via inhibition of NF-κB. J Ethnopharmacol 2015; 174:37-44.
36. Chen YL, Lin SZ, Chang WL i wsp. Requirement for ERK activation in acetone extract identified from Bupleurum scorzonerifolium induced A549 tumor cell apoptosis and keratin 8 phosphorylation. Life Sci 2005; 76:2409-20.
37. Cheng YL, Lee SC, Lin SZ i wsp. Anti-proliferative activity of Bupleurum scrozonerifolium in A549 human lung cancer cells in vitro and in vivo. Cancer Lett 2005; 222:183-93.
38. Kang SJ, Lee YJ, Kim BM i wsp. Effect of Bupleuri Radix extracts on the toxicity of 5-fluorouracil in HepG2 hepatoma cells and normal human lymphocytes. Basic Clin Pharmacol Toxicol 2008; 103:305-13.
39. Wong VK, Li T, Law BY i wsp. Saikosaponin-D, a novel SERCA inhibitor, induces autophagic cell death in apoptosis-defective cells. Cell Death Dis 2013; 4.
40. Li Y, Cai T, Zhang W i wsp. Effects of saikosaponin D on apoptosis in human U87 glioblastoma cells. Mol Med Rep 2017; 16:1459-64.
41. Li C, Guan X, Xue H i wsp. Reversal of P-glycoprotein-mediated multidrug resistance is induced by saikosaponin D in breast cancer MCF-7/adriamycin cells. Pathol Res Pract 2017; 213:848-53.
42. Kumazawa Y, Takimoto H, Nishimura C i wsp. Activation of murine peritoneal macrophages by saikosaponin A, saikosaponin D and saikogenin D. Int J Immunopharmacol 1989; 11:21-8.
43. Kato M, Pu M-Y, Isobe K-I i wsp. Cell type-oriented differential modulatory actions of saikosaponin-D on growth responses and DNA fragmentation of lymphocytes triggered by receptor-mediated and receptor-bypassed pathways. Immunopharmacol 1995; 29:207-13.
44. Chang WL, Chiu LW, Lai JH i wsp. Immunosuppressive flavones and lignans from Bupleurum scorzonerifolium. Phytochem 2003; 64:1375-9.
45. Ushio Y, Oda Y, Abe H. Effect of saikosaponin on the immune responses in mice. Int J Immunopharmacol 1991; 13:501-8.
46. Ushio Y, Abe H. Effects of saikosaponin-D on the functions and morphology of macrophages. Int J Immunopharmacol 1991; 13:493-9.
47. Chiang LC, Ng LT, Liu LT i wsp. Cytotoxicity and anti-hepatitis B virus activities of saikosaponins from Bupleurum species. Planta Med 2003; 69:705-9.
48. Cheng PW, Ng LT, Chiang LC i wsp. Antiviral effects of saikosaponins on human coronavirus 229E in vitro. Clin Exp Pharmacol Physiol 2006; 33:612-6.
49. Chiang LC, Ng LT, Liu LT i wsp. Cytotoxicity and anti-hepatitis B virus activities of saikosaponins from Bupleurum species. Planta Med 2003; 69:705-9.
50. Li Y, Xu C, Zhang Q i wsp. In vitro anti-helicobacter pylori action of 30 Chinese herbal medicines used to treat ulcer diseases. J Ethnopharmacol 2005; 98:329-33.
51. Kumazawa Y, Kawakita T, Takimoto H i wsp. Protective effect of saikosaponin A, saikosaponin D and saikogenin D against Pseudomonas aeruginosa infection in mice. Int J Immunopharmacol 1990; 12:531-7.
52. Xie Y, Lu W, Cao S i wsp. Preparation of Bupleurum nasal spray and evaluation on its safety and efficacy. Chem Pharm Bull 2006; 54:48-53.
53. Abe H, Sakaguchi M, Odashima S i wsp. Protective effect of saikosaponin-D isolated from Bupleurum falcatum L. on CCl4-induced liver injury in the rat. Naunyn Schmiedebergs Arch Pharmacol 1982; 320:266-71.
54. Zhao W, Li JJ, Yue SQ i wsp. Antioxidant activity and hepatoprotective effect of a polysaccharide from Bei Chaihu (Bupleurum chinense DC). Carbohydr Polym 2012; 89:448-52.
55. Fan J, Li X, Li P i wsp. Saikosaponin-D attenuates the development of liver fibrosis by preventing hepatocyte injury. Biochem Cell Biol 2007; 85:189-95.
56. Lee TH, Park SH, You MH i wsp. A potential therapeutic effect of saikosaponin C as a novel dual-target anti-Alzheimer agent. J Neurochem 2016; 136:1232-45.
57. European Food Safety Authority (Online). http://www.efsa.europa.eu/.
58. Food and Agriculture Organization of the United Nations (Online). http://www.fao.org/.
59. Cosmetic Ingredients Database (Online). https://ec.europa.eu.

