© Borgis - Anestezjologia Intensywna Terapia 1/2004, s. 11-17
Małgorzata Knapik1, Piotr Knapik1, Paweł Nadziakiewicz1, Wojciech Saucha1, Jarosław Borkowski1, Anna Dyaczyńska-Herman2
Zapotrzebowanie na remifentanyl w znieczuleniu wziewnym izofluranem podczas rewaskularyzacji naczyń wieńcowych
Requirement for remifentanil during inhaled anaesthesia with isoflurane during coronary bypass surgery
1 Katedra Anestezjologii i Intensywnej Terapii;
kierownik: dr hab. med. P. Knapik – Wydział Lekarski w Zabrzu, Śląska AM w Katowicach
2 Katedra i Klinika Anestezjologii i Intensywnej Terapii;
kierownik: prof. dr hab. n. med. A. Dyaczyńska-Herman – Wydział Lekarski w Katowicach, Śląska AM w Katowicach
Summary
Background. Remifentanil, an ultra-short-acting opioid, is metabolized by non-specific plasma and tissue esterases, and is especially attractive for cardiac procedures because they can be easily divided into stages according to the intensity of nociceptive stimulation. The aim of this prospective study was to assess remifentanil requirement at various stages of coronary artery bypass grafting surgery. Methods. Twenty patients, aged 49-72 yrs and scheduled for CABG, received remifentanil during isoflurane-based anaesthesia at rates adjusted to maintain systolic arterial pressure within ± 20% from baseline values. Mean infusion rates of remifentanil were calculated for every stage. Results. The mean time taken for surgery was 235 ± 34 minutes. The mean infusion rate of remifentanil was 0.22 mcg kg-1 min-1 and was significantly higher in the period between skin incision and sternotomy (0.44 ± 0.23 mcg kg-1 min-1). The rate of infusion during CPB was significantly lower (0.18 ± 0.06 vs. 0.27 ± 0.08 mcg kg-1 min-1, p <0.001). There was no relationship between body temperature and remifentanil dosage. The mean total amount of the drug used during the whole procedure was 5.4 ± 2.0 mg. Conclusions. Remifentanil requirement was highest during the first phase of surgery and gradually decreased during cardiopulmonary bypass. Hypothermia did not influence the analgesic dose of the drug.

Środki analgetyczne należą do podstawowych składowych każdego znieczulenia złożonego. W anestezjologii stosowane są najczęściej krótko działające opioidy o dużej sile działania, których głównym przedstawicielem jest fentanyl i inne leki z tej grupy, jak alfentanyl lub sufentanyl. Remifentanyl jest najnowszym analogiem fentanylu, wprowadzonym niedawno do użytku klinicznego i pierwszym opioidem metabolizowanym przez niespecyficzne esterazy tkankowe i osoczowe. Czas jego działania jest nieporównywalnie krótszy od wszystkich znanych analgetyków narkotycznych. Wiadomo, że środek ten umożliwia nie tylko natychmiastowe dostosowanie stopnia analgezji do zaistniałej sytuacji, lecz również utrzymanie głębokiej analgezji aż do samego końca zabiegu bez obawy o kumulację [1].
Znieczulenie z użyciem remifentanylu rozpoczyna się zwykle od wstrzyknięcia pojedynczej dawki 1 mcg kg-1 min-1, po której następuje wlew ciągły z szybkością od 0,25 do 1 mcg kg-1 min-1. Szybkość wlewu jest modyfikowana w zależności od tego, czy stosowane są równocześnie inne, działające synergistycznie środki. W leczeniu bólu pooperacyjnego wystarcza szybkość podaży od 0,05 do 0,1 mcg kg-1 min-1. Przy dłużej trwających zabiegach, szczególnie jeżeli przewidywany jest nasilony ból pooperacyjny, wskazane jest zastosowanie innych analgetyków na 20-30 minut przed zakończeniem podawania remifentanylu [2, 3, 4]. Farmakokinetyka remifentanylu odpowiada bardziej pojęciu „idealnej”, niż aktualnej masie ciała. Ma to istotne znaczenie u chorych ze znaczną otyłością, ponieważ udowodniono, że w tej grupie chorych podczas znieczulenia z zastosowaniem remifentanylu częściej występuje bradykardia, niebezpieczne spadki ciśnienia tętniczego i inne niekorzystne efekty działania środka [5].
Znieczulenie do zabiegów rewaskularyzacji naczyń wieńcowych powinno zapewniać stabilność układu krążenia podczas zabiegu i we wczesnym okresie pooperacyjnym. Zainteresowanie zastosowaniem remifentanylu w kardioanestezji ciągle rośnie, ponieważ jego kinetyka powinna – teoretycznie – zapewnić głęboką śródoperacyjną analgezję i zarazem umożliwić szybką ekstubację chorych.
Nie określono dotychczas, jakie jest optymalne dawkowanie remifentanylu podczas zabiegu kardiochirurgicznego. W piśmiennictwie nie ma żadnych szczegółowych informacji na ten temat. Michelsen i wsp., którzy określali stężenia remifentanylu w surowicy krwi podczas zabiegu kardiochirurgicznego, stwierdzili, że zastosowanie krążenia pozaustrojowego zwiększa objętość dystrybucji środka o 86%. Wartość ta pozostaje na niezmienionym poziomie podczas trwania perfuzji pozaustrojowej, natomiast szybkość eliminacji zmniejsza się o ponad 6% na każdy 1°C ciepłoty poniżej normotermii. Stężenie remifentanylu obniża się więc istotnie po rozpoczęciu krążenia pozaustrojowego, co powinno powodować konieczność przejściowego zwiększenia szybkości wlewu tego środka bezpośrednio po rozpoczęciu perfuzji pozaustrojowej. W następnej kolejności powinno się zmniejszać szybkość wlewu o 30% na każde 5°C poniżej normotermii [6]. Należy również pamiętać, że szybkość eliminacji może być wyższa, jeżeli podczas trwania krążenia stosowana jest hemofiltracja [7]. Powyższe założenia są jednak teoretyczne i nie zostały dotąd skonfrontowane z rzeczywistą oceną zapotrzebowania na ten analgetyk podczas zabiegu kardiochirurgicznego.
Operacja kardiochirurgiczna składa się z łatwych do wydzielenia etapów z dość przewidywalną stymulacją bólową, w związku z czym stanowi idealny model do przeprowadzenia analizy zapotrzebowania na analgetyki. Celem niniejszej pracy była ocena zapotrzebowania na remifentanyl na poszczególnych etapach zabiegu rewaskularyzacji naczyń wieńcowych z użyciem krążenia pozaustrojowego.
Dobór chorych i metoda
Badania przeprowadzono u pacjentów z chorobą niedokrwienną mięśnia sercowego poddanych operacjom pomostowania tętnic wieńcowych. Badania miały charakter prospektywny. Warunkiem kwalifikacji była wyjściowo dobra funkcja serca (frakcja wyrzutowa lewej komory serca wyższa niż 40%), oraz brak współistniejącej wady zastawkowej, stabilna postać choroby wieńcowej, brak obciążeń ze strony innych narządów oraz wyrażenie przez chorych świadomej, pisemnej zgody na udział w badaniach. Na przeprowadzenie badań uzyskano zgodę Komisji Etyki Badań Naukowych.
Do badań nie kwalifikowano chorych, u których przed operacją:
– stwierdzano obecność niewydolności oddechowej, niewydolności nerek lub wątroby,
– występowały objawy niewydolności krążenia lub niestabilnej choroby wieńcowej, a kwalifikacja do zabiegu odbywała się w trybie pilnym,
– w okresie przedoperacyjnym stosowano ciągły dożylny wlew heparyny lub występowały zaburzenia krzepnięcia krwi,
– w okresie przedoperacyjnym stosowano ciągły dożylny wlew nitrogliceryny.
Przewidziano rezygnację z prowadzenia badań także w czasie ich trwania, jeżeli:
– podczas zabiegu wystąpiły objawy niewydolności mięśnia serca z koniecznością założenia balonu do kontrpulsacji wewnątrzaortalnej lub zastosowania innych metod wspomagania lewokomorowego,
– podczas zabiegu wystąpiły cechy ostrego niedokrwienia mięśnia serca,
– w sali operacyjnej zostały zastosowane podwyższone dawki środków inotropowych (dopuszczano stosowanie dopaminy lub dobutaminy w dawce do 5 mcg kg-1 min-1 po zakończeniu perfuzji pozaustrojowej),
– łączny czas krążenia pozaustrojowego przekroczył 120 minut.
Wszyscy chorzy byli przygotowywani do operacji w sposób typowy. Leki przyjmowane z powodu choroby wieńcowej (beta-adrenolityczne, blokery kanału wapniowego lub nitraty) podawano ostatni raz wieczorem w dniu poprzedzającym zabieg.
Wszyscy chorzy otrzymali standardową premedykację doustną midazolamem na godzinę przed przekazaniem do bloku operacyjnego. Zastosowano następujące przedziały dawkowania: 7,5 mg przy masie ciała poniżej 55 kg, 11,25 mg przy masie ciała od 55 do 80 kg, oraz 15 mg przy masie ciała przekraczającej 80 kg.
Po zarejestrowaniu parametrów wyjściowych następowała losowa, naprzemienna kwalifikacja chorego do grupy (badanej lub kontrolnej). Po przyjeździe do bloku operacyjnego u wszystkich chorych rejestrowano stopień sedacji w skali Ramsaya, saturację krwi włośniczkowej, oraz częstość akcji serca i ciś-nienie tętnicze.
Indukcja w obu grupach została przeprowadzona za pomocą etomidatu (Hypnomidate, Janssen, Belgia) w dawce 0,2 mg kg-1, oraz pankuronium (Pavulon Organon, Holandia) w dawce 0,1 mg kg-1 mc. Środki te podawano minutę po rozpoczęciu podawania analgetyku. Podczas indukcji i prowadzenia znieczulenia stosowano izofluran w stężeniu od 0,6% do 1,5% (Isoflurane, Abbott, USA). W trzy minuty po indukcji przeprowadzano intubację dotchawiczą. Podczas prowadzenia znieczulenia nie były stosowane leki zwiotczające mięśnie poprzecznie prążkowane.
Jako analgetyk podawano remifentanyl (Ultiva, Glaxo Wellcome, UK), wyłącznie we wlewie ciągłym. Podczas indukcji stosowano szybkość wlewu 0,5 mcg kg-1 min-1 przez 5 minut. Po zakończeniu indukcji i przeprowadzeniu intubacji dotchawiczej remifentanyl podawano z szybkością 0,25 mcg kg-1 min-1, a następnie szybkość wlewu regulowano w zależności od reakcji układu krążenia, kierując się wielkością skurczowego ciśnienia tętniczego.
Przez pierwszą część zabiegu jako optymalne utrzymywano skurczowe ciśnienie tętnicze w przedziale ± 20% w stosunku do wartości wyjściowych zarejestrowanych przed indukcją. Przy ciśnieniu poniżej 100 mm Hg (13,3 kPa) i powyżej 130 mm Hg (17,3 kPa) przyjęto wartości graniczne jako wyjściowe. W pomiarach zarejestrowanych po kaniulacji aorty i we wszystkich pomiarach po zakończeniu krążenia pozaustrojowego przyjęto, że optymalne ciśnienie tętnicze zawiera się w przedziale od 80 do 120 mm Hg (10,7-16 kPa), a podczas trwania perfuzji pozaustrojowej – od 60 do 80 mm Hg (8-10,7 kPa). W przypadku wzrostu ciśnienia tętniczego powyżej założonych wartości zwiększano najpierw stężenie izofluranu do maksymalnego stężenia 1,5%, a w następnej kolejności zwiększano szybkość wlewu analgetyku. W przypadku obniżenia ciśnienia tętniczego poniżej założonych wartości zmniejszano najpierw stężenie izofluranu do minimalnego stężenia 0,6%, a w następnej kolejności zmniejszano szybkość wlewu analgetyku do minimalnej wartości 0,05 mcg kg-1 min-1.
W przypadku hipotensji zaplanowano zastosowanie środków interwencyjnych, jeżeli dla uzyskania zadowalających wartości ciśnienia tętniczego nie wystarczałoby przedstawione powyżej postępowanie. Poza okresem krążenia pozaustrojowego obejmowały one – w zależności od sytuacji – albo uzupełnianie wypełnienia łożyska naczyniowego, albo podanie środków ciśnieniowych, jak dopamina lub dobutamina (w dawce do 5 mcg kg-1 min-1). Podczas trwania krążenia pozaustrojowego postępowanie interwencyjne w przypadku obniżek ciśnienia tętniczego obejmowało zastosowanie powtarzanych niewielkich dawek (0,5-1 mg) fenylefryny (Phenylephrine, Sovereign Medical).
Podczas prowadzenia perfuzji pozaustrojowej znieczulenie podtrzymywano za pomocą izofluranu, który podawano wprost do oksygenatora z parownika zamontowanego na pompie do krążenia pozaustrojowego. Operacje wykonywano w normotermii lub w umiarkowanej hipotermii (32-34°C), ale perfuzję pozaustrojową kończono zawsze przy ciepłocie w przełyku 37,5°C. Protekcję mięśnia sercowego zapewniano za pomocą kardioplegii. Utrzymywano wartości hematokrytu przekraczające 22%. U wszystkich chorych został zastosowany standardowy zakres monitorowania hemodynamicznego. Po zamknięciu mostka wszyscy chorzy otrzymywali dożylnie morfinę w dawce 0,15 mg kg-1 mc.
Analizie statystycznej poddano wyjściowe cechy demograficzne, a także czas trwania zabiegu, perfuzji pozaustrojowej i zaklemowania aorty, a także średnie zużycie analgetyku w poszczególnych przedziałach czasowych:
– od indukcji do nacięcia skóry (I),
– od nacięcia skóry do otwarcia klatki piersiowej (II),
– od otwarcia klatki piersiowej do rozpoczęcia krążenia (III),
– od rozpoczęcia krążenia pozaustrojowego do zaklemowania aorty (IV),
– od zaklemowania do odklemowania aorty (V),
– od odklemowania aorty do zakończenia krążenia pozaustrojowego (VI),
– od zakończenia krążenia do zamknięcia klatki piersiowej (VII),
– od zamknięcia klatki piersiowej do zakończenia zabiegu (VIII).
Średnie zużycie analgetyku w mcg kg-1 min-1 (V_REMI) na poszczególnych etapach zabiegu obliczano, notując ilość zużytego środka w mililitrach w danej jednostce czasu (Vt) i czas trwania analizowanego etapu operacji w minutach (t), co przy znanej masie ciała chorego w kg (WT), ilości remifentanylu w mg rozpuszczonego w pompie infuzyjnej (Rmg), oraz objętości pompy w ml (RV), umożliwiało wyliczenie poszukiwanej wartości według wzoru:
V_REMI = (Vt * Rmg * 1000) / (RV * WT * t)
Uzyskane wartości przedstawiono w postaci średnich wraz z odchyleniami standardowymi. Normalność rozkładów sprawdzano testem Kołmogorowa-Smirnowa. W zależności od wyniku stosowano testy parametryczne lub nieparametryczne. Dla prób niepowiązanych zastosowano test t-Studenta lub test Mann-Whitney´a. Dla prób powiązanych zastosowano test t-Studenta lub test Wilcoxona. Dla oceny, który z parametrów w przebiegu czasowym różni się istotnie od pozostałych, zastosowano test analizy wariancji dla pomiarów powtórzonych, oraz test post-hoc Scheffego. Wartości parametrów jakościowych pomiędzy grupami porównywano dwustronnym testem dokładnym Fischera. W obliczeniach wykorzystano oprogramowanie Statistica PL, wersja 5.0. Dla celów wszystkich obliczeń znamienność statystyczna została uznana przy wartości p <0,05.
Wyniki
Badaniami objęto grupę 20 chorych obojga płci w wieku od 49 do 72 lat (średnio 57,2 ± 6,1 lat). Dane demograficzne chorych przedstawiono w tabeli I.
Tabela I. Dane demograficzne badanych chorych
| Parametr | Grupa I (n = 20) |
Wiek (lat)
Wzrost (cm)
Masa ciała (kg)
Wskaźnik masy ciała (kg m-2)
Powierzchnia ciała
(m2)
Frakcja wyrzutowa lewej komory serca (%)
Ryzyko operacyjne w skali EUROscore (pkt.)
Nasilenie dolegliwości wieńcowych (skala CCS) |
57,2 ? 6,1
169,8 ? 9,2
84,3 ? 12,1
29,2 ? 2,7
1,99 ? 0,18
54,9 ? 8,3
2,1 ? 1,7
2,4 ? 0,7
|
| Płeć | męska
żeńska | 18 (90%)
2 (10%) |
| Przebyty zawał mięśnia sercowego | tak
nie | 9 (45%)
11 (55%) |
| Nadciśnienie tętnicze w wywiadzie | tak
nie | 11 (55%)
9 (45%) |
| Zmiany naczyniowe pozasercowe | tak
nie | 5 (25%)
15 (75%) |
| Cukrzyca | tak
nie | 7 (35%)
13 (65%) |
| Przedoperacyjne leczenie za pomocą beta-blokerów | tak
nie | 14 (70%)
6 (30%) |
Podczas trwania zabiegu analizowano średnie szybkości podawania remifentanylu w mcg kg-1 min-1, zarówno w poszczególnych przedziałach czasowych, jak i podczas całej operacji. Okazało się, że przy zastosowaniu tak ściśle określonych zasad dawkowania, średnia szybkość wlewu remifentanylu podczas całego zabiegu wyniosła 0,22 mcg kg-1 min-1.
Średnia szybkość wlewu remifentanylu na etapie od nacięcia skóry do otwarcia klatki piersiowej była wyższa i różniła się istotnie od szybkości wlewu na pozostałych etapach zabiegu. Wartość ta (0,44 ± 0,23 mcg kg-1 min-1) była dwukrotnie wyższa od średniej dla pozostałych etapów, przy dużym rozproszeniu rejestrowanych wartości (tab. II, ryc. 1).
Tabela II. Średnie szybkości podaży remifentanylu i fentanylu w mcg kg-1 min-1 w poszczególnych przedziałach czasowych
| Przedział czasowy | Wartości średnie (n = 20) | Zmiana w stosunku do poprzedniego etapu |
| Od indukcji znieczulenia do nacięcia skóry (I) | 0,25 ? 0,09 | |
| Od nacięcia skóry do otwarcia klatki piersiowej (II) | *0,44 ? 0,23 | Wzrost |
| Od otwarcia klatki piersiowej do rozpoczęcia krążenia (III) | 0,26 ? 0,12 | Spadek |
| Od rozpoczęcia krążenia do zaklemowania aorty (IV) | 0,16 ? 0,07 | Spadek |
| Od zaklemowania do odklemowania aorty (V) | 0,15 ? 0,08 | Bez zmian |
| Od odklemowania aorty do zakończenia krążenia (VI) | 0,21 ? 0,09 | Bez zmian (p = 0,07) |
| Od zakończenia krążenia do zamknięcia klatki piersiowej (VII) | 0,23 ? 0,13 | Bez zmian |
| Od zamknięcia klatki piersiowej do zakończenia zabiegu (VIII) | 0,17 ? 0,12 | Spadek |
| Podczas krążenia pozaustrojowego | 0,17 ? 0,06 | |
| Poza krążeniem pozaustrojowym | 0,27 ? 0,08 | |
| Łącznie podczas zabiegu | 0,22 ? 0,05 | |
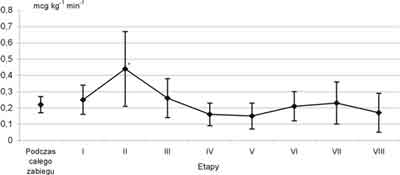
Ryc. 1. Średnie zużycie remifentanylu podczas trwania znieczulenia
* test ANOVA, wartości istotnie różne od pozostałych w teście post-hocScheffego
Okres od nacięcia skóry do przecięcia mostka wymagał znacznego zwiększenia szybkości wlewu, natomiast kolejne dwa etapy (pobierania tętnicy piersiowej wewnętrznej i pierwszy etap krążenia pozaustrojowego) wymagały stopniowego zmniejszenia podaży. Szybkość wlewu trzeba było ponownie (jednak nieznacznie) zwiększyć po odklemowaniu aorty, utrzymać na tym samym poziomie aż do momentu zamknięcia mostka, a następnie ponownie zmniejszyć w końcowej fazie zabiegu (tab. II). Średnia łączna szybkość wlewu remifentanylu podczas perfuzji pozaustrojowej była istotnie niższa od średniej łącznej szybkości wlewu remifentanylu na pozostałych etapach zabiegu (0,18 ± 0,06 mcg kg-1 min-1 vs 0,27 ± 0,08 mcg kg-1 min-1, p <0,001).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Albrecht S, Schuttler J, Yarmusch J: Postoperative pain management after intraoperative remifentanil. Anesth Analg 1999; 89: Suppl, S40-S45.
2. Cohen J, Royston D: Remifentanil. Curr Opin Crit Care 2001; 7: 227-231.
3. Egan TD, Minto CF, Hermann DJ, Barr J, Muir KT, Shafer SL: Remifentanil versus alfentanil. Comparative pharmacokinetics and pharmacodynamics in healthy adult male volunteers. Anesthesiology 1996; 84: 821-833.
4. Wilhelm W, Biedler A, Larsen R: Remifentanil. Early clinical experiences with 3100 patients. Anaesthesist 1997; 46: 992-997.
5. Egan TD: Pharmacokinetics and pharmacodynamics of remifentanil: an update in the year 2000. Curr Opin Anaesth 2000; 13: 449-455.
6. Michelsen LG, Holford NH, Lu W, Hoke JF, Hug CC, Bailey JM: The pharmacokinetics of remifentanil in patients undergoing coronary artery bypass grafting with cardio-pulmonary bypass. Anesth Analg 2001; 93: 1100-1105.
7. Lewis MC, Pacheco D, DeSouza G, Terriet MF: Effects of hemoconcentrator in the CPB circuit on remifentanil requirements. 72nd Clinical and Scientific Congress of the International Anesthesia Research Society, Orlando, USA, 1998. Anesth Analg 1998; 86: Suppl 2, S79.
8. Bowler I, Djaiani G, Hall J, Pugh S, Dunne J: Intravenous remifentanil combined with intrathecal morphine decreases extubation times after elective coronary artery bypass graft (CABG) surgery: Anesth Analg 2000; 90: Suppl 2, S33.
9. Cheng DC, Newman MF, Duke P, Finegan BA, Bukenya D: A prospective randomized, double-blind controlled trial of remifentanil and fentanyl in fast track CABG surgery: efficacy and resource utilization. Annual Meeting of the American Society of Anesthesiologists. Dallas, USA, 1999. Anesthesio-logy 1999; 91: Suppl, A142.
10. Howie MB, Cheng D, Newman MF, Pierce ET, Hogue C, Hillel Z, Bowdle TA, Bukenya D: A randomized double-blinded multicenter comparison of remifentanil versus fentanyl when combined with isoflurane/propofol for early extubation in coronary artery bypass graft surgery. Anesth Analg 2001; 92: 1084-1093.
11. Mollhoff T, Herregods L, Blake D, MacAdams C, Kirkham A: Remifentanil versus fentanyl in patients undergoing CABG surgery. Annual Meeting of the American Society of Anesthesiologists. Dallas, USA, 1999. Anesthesiology 1999; 91: Suppl, A144.
12. Mollhoff T, Herregods L, Moerman A, Blake D, MacAdams C, Demeyere R, Kirno K, Dybvik T, Shaikh S – Remifentanil Study Group 2: Comparative efficacy and safety of remifentanil and fentanyl in „fast track” coronary artery bypass graft surgery: a randomized, double-blind study. Br J Anaesth 2001; 87: 718-726.
13. Olivier P, Sirieix D, Baron JF: Evaluation of target controlled infusion (TCI) of remifentanil in combination of TCI propofol in cardiac surgery. Br J Anaesth 1999; 82: Suppl 1, 15-16.
14. Degoute CS, Ray MJ, Manchon M, Dubreuil C, Banssillon V: Remifentanil and controlled hypotension, comparison with nitroprusside or esmolol during tympanoplasty. Can J Anaesth 2001; 48: 20-27.
15. Servin F: Remifentanil: when and how to use it. Eur J Anaesthesiol 1997; 15:Suppl, 41-44.
16. Andres J: Podstawy kardioanestezji; w: Wybrane zagadnienia anestezjologii i intensywnej terapii w chirurgii serca i naczyń. (Red. Andres J, Wąsowicz M), Danbert, Kraków 2002.
17. Szczurek D, Andres J: Znieczulenie w kardioanestezji; w: Wybrane zagadnienia anestezjologii i intensywnej terapii w chirurgii serca i naczyń (Red. Andres J, Wąsowicz M), Danbert, Kraków 2002; 67-86.
18. Lehmann A, Zeitler C, Thaler E, Isgro F, Boldt J: Comparison of two different anesthesia regimens in patients undergoing aortocoronary bypass grafting surgery: sufentanil-midazolam versus remifentanil-propofol. J Cardiothorac Vasc Anesth 2000; 14: 416-420.
19. Olivier P, Sirieix D, Dassier P, D´Attellis N, Baron JF: Continuous infusion of remifentanil and target-controlled infusion of propofol for patients undergoing cardiac surgery: a new approach for scheduled early extubation. J Cardiothorac Vasc Anesth 2000; 14: 29-35.
20. Goździk W, Durek G, Falkiewicz Z, Kübler A: Znieczulenie całkowicie dożylne z zastosowaniem ciągłego wlewu remifentanylu oraz propofolu metodą TCI do zabiegów chirurgicznej rewaskularyzacji wieńcowej z zastosowaniem krążenia pozaustrojowego. Anest Inten Ter 2002; 34: 105-109.
21. Lehmann A, Boldt J, Rompert R, Thaler E, Kumle B, Weisse U: Target-controlled infusion or manually controlled infusion of propofol in high-risk patients with severely reduced left ventricular function. J Cardiothorac Vasc Anesth 2001; 15: 445-450.

