© Borgis - Anestezjologia Intensywna Terapia 3/2004, s. 195-199
Mirosław Ziętkiewicz 1, 4, Marcin Wąsowicz 1, 4, Andrzej Gackowski 3, 4, Rafał Drwiła 1, 4, Jerzy Sadowski 2, 4, Janusz Andres 1, 4
Trudności w leczeniu ciężkiego zwężenia drogi odpływu lewej komory u chorej z kardiomiopatią przerostową
Systolic anterior motion of the mitral valve complicating percutaneous transluminal septal myocardial ablation in a patient with hypertrophic obstructive cardiomyopathy. Case report.
1Katedra Anestezjologii i Intensywnej Terapii CM UJ w Krakowie
2Klinika Chirurgii Serca, Naczyń i Transplantologii CM UJ w Krakowie
3Klinika Choroby Wieńcowej CM UJ w Krakowie
4Krakowski Szpital Specjalistyczny im. Jana Pawła II
Summary
Background. Abnormal mitral valve coaptation due to systolic anterior motion is a rare phenomenon usually observed in hypertrophic obstructive cardiomyopathy (HOCM). Case report. A 70-yr-old woman with HOCM and left ventricular outflow tract (LVOT) obstruction underwent percutaneous transluminal alcohol septal ablation of the first septal branch of the left coronary artery. Following surgery, her clinical condition deteriorated and inotropic support was necessary. Transoesophageal echocardiography (TEE) revealed critical obstruction of the left outflow tract (2 mm) through ventricular septal muscles and systolic anterior motion (SAM) of the mitral valve, with a gradient of 148 mm Hg (19.7 kPa). An emergency "Morrow” septal myomectomy was performed and a mechanical mitral valve implanted. The gradient decreased to 56 mm Hg (7.47 kPa) with significant improvement in left ventricular contractility. Postoperative renal failure occurred and the patient required dialysis for 7 days. A subsequent TEE revealed a minimal gradient of 12 mm Hg (1,6 kPa) and widening of the LVOT. Discussion and conclusions. SAM is usually caused by a Venturi phenomenon, occurring in the narrowed portion of the LVOT with abnormal left ventricular geometry. Obstruction of the LVOT and mitral insufficiency may lead to increases in left atrial pressure and pulmonary arterial pressure, with subsequent cardiac failure. This pathology can be diagnosed and intraoperatively controlled by TEE. Conservative pharmacologic treatment should aim at reduction of the pressure gradient across the LVOT by administration of beta-blockers and maintenance of a slow sinus rhythm. Prevention of atrial fibrillation is essential. Surgical correction of the stenosis should be undertaken when percutaneous septal ablation fails.

Anest Inten Terap 2004; 36, 195-199
Opis przypadku
70-letnia pacjentka z rozpoznaniem kardiomiopatii przerostowej (HOCM) ze znacznym zwężeniem drogi odpływu z lewej komory (LVOT), została zakwalifikowana do przeznaczyniowej ablacji alkoholowej gałęzi przegrodowej lewej tętnicy wieńcowej. Pomimo weryfikacji zakresu unaczynienia wybranej tętnicy echokardiograficznym badaniem kontrastowym, po podaniu alkoholu etylowego doszło do raptownego pogorszenia stanu chorej, zwiększenia gradientu w drodze odpływu lewej komory i znacznego obniżenia ciśnienia tętniczego. Próba podania płynów oraz leków beta-adrenolitycznych doprowadziła do wystąpienia znacznego zastoju w krążeniu płucnym z narastającą dusznością, bez spodziewanego obniżenia gradientu w LVOT. Również próba leczenia w oparciu o monitorowanie cewnikiem Swana-Ganza i zastosowanie leków działających inotropowo dodatnio nie przyniosła poprawy stanu chorej. Jedynym sposo-bem utrzymania ciśnienia tętniczego na poziomie 90/50 mm Hg (12/6,7 kPa) było stosowanie dużych dawek leków naczynioskurczowych. W badaniu echokardiograficznym stwierdzono znacznie większy niż przed zabiegiem skurczowy ruch do przodu przedniego płatka zastawki mitralnej (SAM) i wynikającą z pociągania płatka falę zwrotną II/III stopnia do lewego przedsionka.
W związku z niestabilnością hemodynamiczną, brakiem reakcji na leczenie farmakologiczne i rozwojem anurii chora została pilnie zakwalifikowana do operacji kardiochirurgicznej – miomektomii przegrody międzykomorowej. Na stole operacyjnym wykonano przezprzełykowe badanie echokardiograficzne (TEE, Hewlett Packard Sonos 2500 z głowicą wielopłaszczyznową 5 MHz). Badanie potwierdziło obecność znacznego asymetrycznego przerostu podstawnego seg-mentu przegrody międzykomorowej (22 mm), który wpuklał się do LVOT. Ponadto stwierdzono wydłużenie przedniego płatka zastawki mitralnej oraz jego nasilony skurczowy ruch do przodu (SAM) powodujący falę zwrotną II/III stopnia do lewego przedsionka. Skurczowe wpuklanie się przegrody oraz SAM powodowały ciężkie zaciskanie LVOT (maksymalna odległość między płatkiem a przegrodą <2 mm) z maksymalnym gradientem skurczowym 148 mm Hg (19,8 kPa) (ryc. 1 i 2).

Ryc. 1. Stan po ablacji alkoholowej, echokardiograficzne badanie przezprzełykowe. Widoczny masywny wał przegrody międzykomorowej (IVS) oraz przedni płatek zastawki mitralnej powodujący zawężenie drogi odpływu podczas skurczu (SAM). LA – lewy przedsionek, LV – lewa komora, Ao – zastawka aortalna.
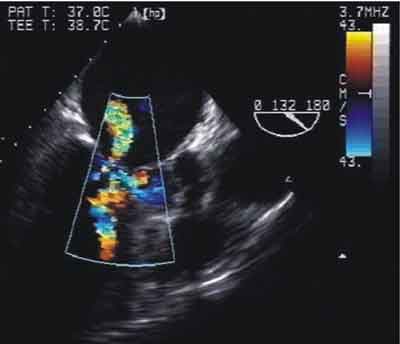
Ryc. 2. Obraz echokardiograficzny (TEE) z użyciem techniki kolorowego Dopplera. Identyczne ułożenie głowicy jak na rycinie poprzedniej. Widoczny turbulentny przepływ o dużej prędkości w obrębie LVOT oraz fala niedomykalności mitralnej.
Po otwarciu aorty chirurg stwierdził wizualnie i palpacyjnie wał mięśniowy przegrody z ciasnym zwężeniem LVOT. Wykonano nacięcie klinowe metodą Morrow uzyskując znaczne poszerzenie LVOT pozwalające na swobodne wprowadzenie palca do lewej komory [1]. Po uruchomieniu serca badanie TEE wykazało, że wał przegrody jest znacznie cieńszy, jednak utrzymywał się SAM z gradientem powyżej 120 mm Hg (16 kPa), nieustępujący pomimo dobrego wypełnienia serca. Ponownie włączono krążenie pozaustrojowe i poszerzono nacięcie komory. Kolejne uruchomienie serca wykazało obraz podobny jak poprzednio. Ze względu na obecność martwicy po wykonanej ablacji alkoholowej chirurg uznał, że bardziej radykalne wycięcie przegrody może grozić jej perforacją. Podjęto decyzję o usunięciu przedniego płatka mitralnego i wszczepieniu sztucznej zastawki mitralnej St. Jude Medical 27M Masters. Ze względu na obserwowany całkowity blok przedsionkowo-komorowy naszyto elektrody nasierdziowe do stymulacji dwujamowej. Po ostatecznym zatrzymaniu krążenia pozaustrojowego stwierdzono obniżenie gradientu maksymalnego do 56 mm Hg (ryc. 3). Całkowity czas zakleszczenia aorty wyniósł 85 minut, a łączny czas trwania krążenia pozaustrojowego 120 minut.

Ryc. 3. Stan po wszczepieniu sztucznej zastawki mitralnej (TEE). Widoczna redukcja grubości wału mięśniowego i poszerzenie LVOT do 11 mm.
W okresie pooperacyjnym w kolejnych badaniach echokardiograficznych obserwowano dalsze zmniejszenie gradientu do wartości 15 mm Hg (2 kPa). Droga odpływu lewej komory miała prawidłową szerokość. Grubość mięśnia przegrody międzykomorowej uległa redukcji (minimalnie 3 mm) i nie wystąpiła jej perforacja (ryc. 4). Pacjentka wymagała przedłużonej wentylacji mechanicznej (3 doby wentylacji w trybie SIMV z Pressure Support). Wobec utrzymującej się przez pierwszy tydzień pooperacyjny anurii stosowano zabiegi przerywanej hemodializy żylno-żylnej jako terapię nerkozastępczą. Po tygodniu nastąpił powrót diurezy, a po następnych 7 dniach chorą przekazano do oddziału chirurgicznego. Ze względu na całkowity blok przedsionkowo-komorowy wszczepiono stymulator dwujamowy (Biotronic, Axios D, USA) i po dalszym 10-dniowym leczeniu chorą wypisano do domu w stanie dobrym.
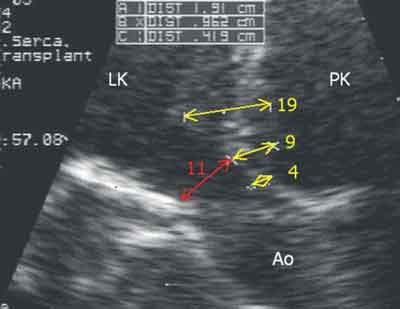
Ryc. 4. Stan w trzecim dniu po operacji, przezklatkowe badanie echokardiograficzne. Widoczna dalsza redukcja grubości wału mięśniowego przegrody międzykomorowej, w najgrubszym miejscu 19 mm, w najcieńszym ok. 4 mm. Średnica LVOT poszerzona została do 11 mm.
Omówienie
Nieprawidłowy skurczowy ruch do przodu płatka zastawki mitralnej (SAM) może powodować czynnościowe zwężenie drogi odpływu lewej komory [2]. Zjawisko to może mieć istotne znaczenie w okresie okołooperacyjnym powodując trudne w leczeniu zaburzenia hemodynamiczne. Występowanie SAM wiąże się najczęściej z HOCM [3, 4], gdzie wysoki gradient w zwężonej drodze odpływu (LVOT) nasilany jest dodatkowo przez przedni płatek mitralny zamykający światło, niekiedy aż do wystąpienia kontaktu płatka z przegrodą międzykomorową. Pociąganie płatka w kierunku przegrody może równocześnie powodować niedomykalność mitralną.
Za patofizjologiczne podłoże SAM uznaje się dwa mechanizmy:
1) efekt Venturiego wywołany wzrostem systolicznej prędkości przepływu w zawężonym LVOT [5];
2) zmianę geometrii komory, z przemieszczeniem mięśni brodawkowatych centralnie i do przodu [6, 7]
SAM może dodatkowo nasilać wydłużenie nici ścięgnistych przedniego płatka mitralnego (ryc. 5). W powstawaniu SAM podkreśla się rolę współdziałania obu płatków mitralnych i ich wzajemnej koaptacji lub jej braku [8].
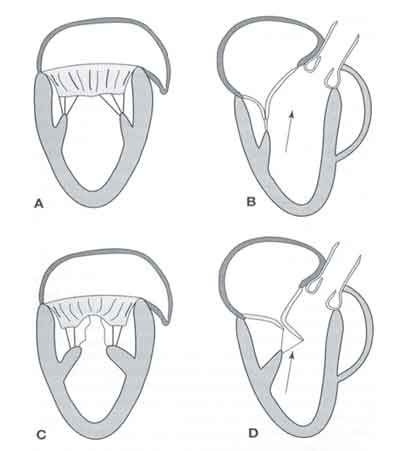
Ryc. 5. Nieprawidłowe położenie mięśni brodawkowatych jako mechanizm powstawania SAM.
A i B: Prawidłowa anatomia struktur zastawki mitralnej. C: Dośrodkowe przesunięcie mięśni brodawkowatych powoduje osłabienie wsparcia dla środkowych segmentów płatków zastawki mitralnej. D: Przesunięcie mięśnia brodawkowatego ku przodowi ustawia przedni płatek zastawki mitralnej w drodze odpływu z lewej komory.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Morrow AG: Hypertrophic subaortic stenosis: operative methods utilized to relieve left ventricular outflow obstruction. J Thorac Cardiovasc Surg 1978; 76: 423-430.
2. Shah PM, Taylor RD, Wong M: Abnormal mitral valve coaptation in hypertrophic obstructive cardiomyopathy: proposed role in systolic anterior motion of the mitral valve. Am J Cardiol 1981; 48: 258-262.
3. Maron BJ, Harding AM, Spirito P, et al: Systolic anterior motion of the posterior mitral leaflet: a previously unrecognized cause of dynamic subaortic obstruction in patients with hypertrophic cardiomyopathy. Circulation 1983; 68: 282-293.
4. Roberts R, Sigwart U: New concepts in hypertrophic cardiomyopathies, Part II. Circulation 2001; 104: 2249-2252.
5. Obadia JF: Second order anterior mitral leaflets play a role in preventing systolic anterior motion. Ann Thorac Surg 2002; 73: 1688-1696.
6. Klues HG, Roberts WC, Maron BJ: Morphologic determinants of echocardiographic patterns of mitral valve systolic anterior motion in hypertrophic obstructive cardiomyopathy. Circulation 1993; 87: 1570-1579.
7. Levine RA, Vlahakes GJ, Lefebvre X, Guerrero J-L, Cape EG, Yoganathan AP, Weyman AE: Papillary muscle displacement causes systolic anterior motion of the mitral valve. Experimental validation and insights into the mechanism of subaortic obstruction. Circulation 1995; 91: 1189-1195.
8. Schwammenthal E, Nakatani S, He S, Hopmeyer J, Sagie A, Weyman AE, Lever HM, Yoganathan AP, Thomas JD, Levine RA: Mechanism of mitral regurgitation in hypertrophic cardiomyopathy. Mismatch of posterior to anterior leaflet length and mobility. Circulation 1998; 98: 856-865.
9. Lee KS, Stewart WJ, Lever HM, Underwood PL, Cosgrove DM: Mechanism of outflow tract obstruction causing failed mitral valve repair-anterior displacement of leaflet coaptation. Circulation 1993; 88: 24-29.
10. Matsui Y, Shiiya N, Murashita T, Sasaki S, Yasuda K: Mitral valve repair and septal myectomy for hypertrophic obstructive cardiomyopathy. J Cardiovasc Surg 2000; 41: 53-56.
11. Jebara VA, Mihaileanu S, Acar C, Brizard C, Grare P, Latremouille C, Chauvaud S, Fabiani JN, Deloche A, Carpentier A: Left ventricular outflow tract obstruction after mitral valve repair. Results of the sliding leaflet technique. Circulation 1993; 88: 1130-1134.
12. Gietzen FH, Leuner CJ, Raute-Kreinsen U, et al: Acute and long-term results after transcoronary ablation of septal hypertrophy (TASH): catheter interventional treatment for hypertrophic obstructive cardiomyopathy. Eur Heart J 1999; 20: 1342-1354.
13. Grigg LE, Wigle ED, Williams WG, Daniel LB, Rakowski H: Transesophageal Doppler echocardiography in obstructive hypertrophic cardiomyopathy: clarification of patho-physiology and importance in intraoperative decision making. J Am Coll Cardiol 1992; 20: 42-52.
14. Rescigno G, Matteucci MLS, Iacovoni A, Banfi C, Seddio F, Lorini L, Giamundo B, Ferrazzi P: Systolic anterior motion after mitral valve repair: myectomy as an alternative solution. J Thorac Cardiovasc Surg 2003; 126: 1197-1198.





