Tadeusz Wolski1, 2, *Agnieszka Najda2, Katarzyna Wolska-Gawron3
Czarnuszka damasceńska (Nigella damascena L.) – zawartość i skład lipidów oraz olejku występującego w nasionach
Nigella damascena L. – composition of lipids and essential oil found in seeds
1Katedra i Zakład Farmakognozji z Pracownią Roślin Leczniczych, Uniwersytet Medyczny w Lublinie
Kierownik Katedry i Zakładu: dr hab. n. farm. Grażyna Zgórka
2Katedra Warzywnictwa i Roślin Leczniczych, Uniwersytet Przyrodniczy w Lublinie
Kierownik Katedry: prof. dr hab. n. roln. Halina Buczkowska
3Katedra i Klinika Dermatologii, Wenerologii i Dermatologii Dziecięcej, Uniwersytet Medyczny w Lublinie
Kierownik Katedry i Kliniki: prof. dr hab. n. med. Dorota Krasowska
Streszczenie
Wstęp. Nigella damascena L. jest jednym z najważniejszych gatunków rodzaju Nigella L. Roślina ta w wielu rejonach świata używana jest jako przyprawa i bywa traktowana na równi z czarnuszką siewną. Walory dietetyczno-smakowe czarnuszki damasceńskiej wynikają głównie ze specyficznego składu chemicznego nasion, który jest modyfikowany terminem zakładania plantacji (siewu nasion).
Cel pracy. W pracy podjęto badania mające na celu określenie wpływu terminu siewu nasion na zawartość i skład lipidów oraz olejków eterycznych występujących w owocach czarnuszki.
Materiał i metody. Siew nasion czarnuszki damasceńskiej przeprowadzono bezpośrednio do gruntu w dwóch terminach: I – 19.04 i II – 14.05. Zbiór nasion przeprowadzono wielofazowo w miarę ich dojrzewania. W badaniach laboratoryjnych wykorzystano nasiona czarnuszki damasceńskiej pozyskane z własnych upraw i porównano ich skład z nasionami handlowymi. W surowcach oznaczono zawartość procentową oleju tłustego i olejku eterycznego. Określono skład jakościowy i ilościowy kwasów tłuszczowych i poszczególnych składników olejków eterycznych.
Wyniki. Z przeprowadzonych badań agrotechnicznych wynika, że większy plon nasion uzyskano z roślin wyrosłych z wczesnego terminu siewu (średnio 270 g • m-2). Opóźnienie terminu siewu nasion o 10 dni powodowało znaczne obniżenie plonowania (średnio 193 g • m-2). Z nasion czarnuszki damasceńskiej z drugiego terminu siewu uzyskano około 7% więcej oleju tłustego, jednak o mniejszej zawartości NNKT, tj. o ok. 16,0% w stosunku do nasion z pierwszego terminu siewu. Stwierdzono również, że nasiona otrzymane z pierwszego terminu siewu charakteryzowały się o ponad połowę niższą w stosunku do nasion otrzymanych z drugiego terminu siewu zawartością olejku eterycznego.
Wnioski. Termin siewu w istotny sposób modyfikował zawartość substancji czynnych w surowcu czarnuszki damasceńskiej. Opóźnienie terminu siewu nasion korzystnie wpłynęło na zawartość lipidów i olejku eterycznego, jednak gorszej jakości.
Summary
Introduction. Nigella damascena L. is one of the most important species of the genus Nigella L. This plant is used in many parts of the world as a spice and sometimes is valued as much as Nigella sativa L. The dietary and tasteful qualities of Nigella damascena L. are mainly due to the specific chemical composition of the seeds which is modified by the time of establishing the plantation (sowing the seeds).
Aim. In the study, a study was undertaken to determine the effect of the sowing date on the content and composition of lipids and essential oils found in the black cumin fruits.
Material and methods. Sowing seeds of Nigella damascena L. was carried out directly to the ground in two dates: I – 19.04 and II – 14.05. The seed collection was carried out in multiphase as they matured. Laboratory seeds used Nigella damascena L. seeds obtained from their own crops and compared their composition with commercial seeds. The percentage of oily oil and essential oil was determined in the raw materials. The qualitative and quantitative composition of fatty acids and individual components of essential oils was determined.
Results. The results of the conducted agrotechnical studies show that larger seed yield was obtained from the plants of the early sowing date (on average 270 g • m-2). Delaying the sowing date by ten days resulted in a significant decrease in yield (on average 193 g • m-2). From the seeds of Nigella damascena L. from the second date of sowing about 7% more oil was obtained. However, the content of EFA was about 16.0% lower compared to the seeds from the first sowing date. It was also found that the seeds obtained from the first sowing date were characterized by more than a half lower content of essential oil in relation to the seeds obtained from the second sowing date.
Conclusions. The sowing date significantly modified the content of active substances in the raw material of black cumin. Delaying the date of seed sowing had a positive effect on the content of lipids and essential oil, however, inferior quality.

Wprowadzenie
Czarnuszka damasceńska (Nigella damascena L.) jest jednym z najważniejszych gatunków rodzaju Nigella L. pokrewnym czarnuszce siewnej (1-5). Czarnuszka damasceńska pochodzi z południowej Europy i Ameryki Północnej (6, 7). Roślina ta nie jest używana jako przyprawa, chociaż w niektórych krajach azjatyckich jest traktowana na równi z czarnuszką siewną (8-10). Wynika to ze składu chemicznego nasion i działania farmakologicznego (11-13). Obszarami głównego jej użytkowania jest Europa (kraje śródziemnomorskie) oraz północna Afryka i zachodnia Azja (14). W Polsce roślina ta łatwo dziczeje, a jej uprawa prowadzona jest na południu kraju (15-19).
Czarnuszka damasceńska jest jednoroczną rośliną zielną z rodziny jaskrowatych (Ranunculaceae), o prostej, obficie rozgałęzionej łodydze dorastającej do 70 cm wysokości (ryc. 1). Pędy wzniesione są niezależnie w górę i bogato ulistnione. Roślina ma delikatne ciemnozielone, podwójnie pierzastosieczne liście oraz okazałe pięciopłatkowe lub pełne kwiaty z ostrogą o białej, różowej lub niebieskiej barwie i obficie kwitnące (20, 21). Początek kwitnienia rośliny przedstawiono na rycinie 2. Rycina 3 obrazuje czarnuszkę damasceńską w pełni kwitnienia, zaś okazałe kwiaty w różnych fazach rozwoju przedstawia rycina 4a-c. Dość duże niedojrzałe owocostany mają barwę jasnoseledynową, zaś dojrzałe brunatną. Składają się one z rozdętych i całkowicie zrośniętych mieszków. Nasiona wyglądem zbliżone są do nasion czarnuszki siewnej, lecz są nieco większe i lśniące, o kształcie odwrotnie jajowatym. W tabeli 1 podano cechy budowy morfologicznej, pozwalające na identyfikację gatunków Nigella L.

Ryc. 1. Kwitnąca czarnuszka damasceńska (Nigella damascena L.)

Ryc. 2. Początek kwitnienia czarnuszki damasceńskiej

Ryc. 3. Rośliny czarnuszki damasceńskiej w pełni kwitnienia



Ryc. 4a-c. Kwiaty czarnuszki damasceńskiej w pełni kwitnienia
Tab. 1. Niektóre cechy budowy morfologicznej trzech gatunków Nigella
| Część rośliny | Gatunek |
| czarnuszka damasceńska | czarnuszka siewna | czarnuszka polna |
| Kwiaty | barwa: biała, różowa lub niebieska
średnica: do 6 cm, otoczone nitkowatymi przykwiatkami | barwa: biała z niebieskimi żyłkami
średnica: do 3 cm | barwa: zielonkawoniebieska
średnica: do 4 cm, otoczone liśćmi przykwiatkowymi |
| Owoce (nasiona) | zapach: po roztarciu landrynkowy
długość: 2,0-2,5 mm
szerokość: 1,5-1,8 mm
mieszki: rozdęte, błoniaste, okazałe | zapach: po roztarciu naftowy
długość: 2,5-2,8 mm
szerokość: 1,2-1,4 mm
mieszki: wąskie, zrośnięte u dołu | zapach: niecharakterystyczny
długość: 2,0-2,5 mm
szerokość: 1,0-1,4 mm
mieszki: wąskie, nagie, do połowy zrośnięte |
Poprzednia praca (22) dotyczyła zawartości i składu lipidów oraz olejku eterycznego występujących w nasionach czarnuszki siewnej (Nigella sativa L.).
Cel pracy
Celem niniejszego opracowania jest określenie dynamiki wzrostu i plonowania oraz ocena składu chemicznego oleju tłustego i olejku eterycznego występujących w nasionach czarnuszki damasceńskiej (Nigella damascena L.).
Materiał i metody
Siew nasion czarnuszki damasceńskiej przeprowadzono bezpośrednio do gruntu w dwóch terminach: I – 19.04 i II – 14.05. Po wschodach roślin prowadzono obserwacje faz rozwojowych i pomiary cech biometrycznych roślin czarnuszki damasceńskiej. Zbiór nasion przeprowadzono wielofazowo w miarę ich dojrzewania (23). Do badań laboratoryjnych użyto nasiona handlowe czarnuszki damasceńskiej oraz nasiona własne pochodzące z roślin wyrosłych z nasion, których siew przeprowadzono w dwóch terminach.
W badanych surowcach oznaczano zawartość procentową oleju tłustego według zmodyfikowanej metody Soxhleta (ekstrakcyjno-wagowej) przy użyciu aparatu Soxtec HT-6 (Tecator) (24). Następnie określono skład jakościowy i ilościowy kwasów tłuszczowych, jako estrów metylowych metodą GC, przy użyciu aparatu Unicam-610 z kolumną HP-23 o długości 60 m, średnicy 0,25 mm i grubości filmu 0,25 μm. Temperatura detektora i dozownika wynosiła 250°C, zaś kolumny 180°C, przy przepływie gazu nośnego V = 2 cm3/min, stosując metodę wzorca wewnętrznego, którym był kwas heptadekanowy.
Zawartość olejków eterycznych (OE) określono w aparacie Clevengera według FP X (25). Skład jakościowy i ilościowy poszczególnych składników OE wyznaczono metodą GC/MS, przy użyciu aparatu ITS-40 (układ GC/ITMS firmy Finnigan MAT, USA) z kolumną DB-5 (J&W, USA) o długości 30 m, średnicy 0,25 mm i grubości filmu fazy stacjonarnej 0,25 μm. Temperatura dozownika wynosiła 280°C. Stosowano gradient temperatury (35°C przez 2 min, następnie przyrost o 4°C do 280°C). Analizę jakościową przeprowadzano na podstawie widm MS, porównując je z widmami biblioteki NIST (62 tys. widm) oraz z biblioteką terpenów LIBR (TR) dostarczoną przez Finnigan MAT. Tożsamość związków potwierdzano indeksami retencji z danych piśmiennictwa i własnych (26). Skład ilościowy OE określono, przyjmując, że suma poszczególnych związków olejkowych stanowi 100%.
Wyniki i ich omówienie
Do najczęściej uprawianych odmian czarnuszki damasceńskiej należą: „Miss Jekyll” – osiągająca 50 cm wysokości i kwiatach o niebieskiej barwie, „Blue Midget” – roślina o wysokości do 25 cm i błękitnym zabarwieniu kwiatów, „Miss Jekyllhybrys” – roślina wysoka do 70 cm o kwiatach podwójnych o barwie białej, różowej i niebieskiej, a także odmiana z grupy Persian Jawel o kwiatach białych, różowych i niebieskich (27, 28). Czarnuszkę damasceńską uprawia się wyłącznie z siewu nasion do gruntu. Nasiona przeznaczone do siewu muszą spełniać następujące wymagania: zdolność kiełkowania nie mniejsza niż 55%, czystość nasion 97% oraz wilgotność nasion nieprzekraczająca 11%. Nasiona zachowują zdolność kiełkowania przez 2-3 lata (29, 30).
Nasiona wprost do gruntu wysiewa się w różnych terminach, najczęściej w marcu, kwietniu lub maju i czerwcu, aby rośliny zakwitły pod koniec lata. Do obsiania powierzchni jednego ara pola należy wysiać od 70 do 100 g nasion. Podobnie jak nasiona czarnuszki siewnej, również nasiona czarnuszki damasceńskiej kiełkują tylko w ciemności (31, 32). Czarnuszka damasceńska lubi gleby szybko nagrzewające się, średnio zwięzłe i żyzne. Gleby winny być zasobne w składniki pokarmowe, niezaskorupiające się, o dobrych stosunkach powietrzno-wodnych oraz o odczynie od lekko kwaśnego do obojętnego. Szczegółowe parametry przygotowania gleby podają Laskowska i Karczmarz (28). Uzyskane przez nas wyniki dotyczące dynamiki wzrostu roślin czarnuszki damasceńskiej przedstawia rycina 5.
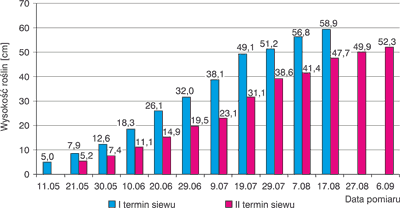
Ryc. 5. Dynamika wzrostu czarnuszki damasceńskiej w zależności od terminu siewu nasion
Z przeprowadzonych badań agrotechnicznych wynika, że plon nasion czarnuszki damasceńskiej w istotny sposób zależy od terminu siewu nasion. Większy plon nasion uzyskano z roślin wyrosłych z pierwszego terminu siewu (średnio 270 g/m2) w porównaniu do plonu, jaki otrzymano z roślin wyrosłych z drugiego terminu siewu nasion (średnio 193 g/m2).
W badanych surowcach określano zawartość procentową oleju tłustego występującego w nasionach czarnuszki damasceńskiej (tab. 2).
Tab. 2. Zawartość procentowa oleju tłustego w nasionach czarnuszki damasceńskiej Nigella damascena L.
| Rodzaj użytego surowca | Zawartość oleju tłustego w nasionach
(%) |
| Nasiona otrzymane z pierwszego terminu siewu (19.04) | 35,02 |
| Nasiona otrzymane z drugiego terminu siewu (14.05) | 42,15 |
| Nasiona handlowe użyte do siewu | 38,03 |
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Andersson S. Genetic constraints on phenotypic evolution in Nigella (Ranunculaceae). Biological J Linnean Soc 1997; 62:519-32.
2. Macku J, Krejca J. Atlas roślin leczniczych. Ossolineum, Warszawa 1989; 38-9.
3. Rumińska M, Ożarowski A. Leksykon roślin leczniczych. PWRiL Warszawa 1990; 121.
4. Bremness L. Wielka księga ziół. Wiedza i Życie, Warszawa 1991; 81.
5. Lavrenov VK, Lavrenova GV. The full encyclopaedia of medicinal plants. Neva, St.-Petersburg 1999; 815.
6. Andersson S. Sex-allocation trade-offs in Nigella sativa (Ranunculaceae) examined with flower manipulation experiments. Evolution Ecol 2003; 17:125-38.
7. Heiss AG, Oeggl K. The oldest evidence of Nigella damascena L. (Ranunculaceae) and its possible introduction to central Europe. Veget Hist Archaeobot 2005; 14:562-70.
8. Delphine M, Kelly MT, Meunier S i wsp. Morphological, microscopic and chemical comparison between Nigella sativa L. cv (black cumin) and Nigella damascena L. cv. J Food Agric Environ 2013; 11(1):165-71.
9. Warrier PK, Nambiar VP, Ramankutty C. Indian medicinal plants – a compendium of 500 species. Orient Longman Pvt Ltd, Chennai 2004; 139-42.
10. Wichtl M. Herbal drugs and phytopharmaceuticals. Medpharm GmBH, Stuttgart 2004; 416-7.
11. Sajfrtova M, Sovova H, Karban J. Enrichment of Nigella damascena extract with volatile compounds using supercritical fluid extraction. J Supercrit Fluids 2014; 94:160-4.
12. Telci I, Sahin-Yaglioglu A, Eser F i wsp. Comparison of seed oil composition of Nigella sativa L. and N. damascena L. during seed maturation stages. J Am Oil Chem Soc 2014; 91:1723-9.
13. Farag MA, Gad HA, Heiss AG i wsp. Metabolomics driven analysis of six Nigella species seeds via UPLC-qTOF-MS and GC-MS coupled to chemometrics. Food Chem 2014; 151:333-42.
14. Boskabady MH, Vahedi N, Amery S i wsp. The effect of Nigella sativa alone, and in combination with dexamethasone, on tracheal muscle responsiveness and lung inflammation in sulfur mustard exposed guinea pigs. J Ethnopharmacol 2011; 137(2):1028-34.
15. Broda B, Mowszowicz J. Przewodnik do oznaczania roślin leczniczych. PZWL, Warszawa 1985; 227-8.
16. Kozłowski J. Czarnuszka siewna i gatunki jej pokrewne. Wiad Ziel 1990; 32(7):19-20.
17. Levy P. The New Royal Horticultural Society Dictionary of Gardening. The Macmillan Press Limited, London, the Stockton Prees, New York 1992; 321-3.
18. Rejowski M. Rośliny przyprawowe i używki roślinne. PWRiL, Warszawa 1992; 59.
19. Dedio I. Rośliny zielarskie w apteczce domowej i w kuchni. Wiad Ziel 1999; (5):10.
20. Wolski T, Najda A, Dyduch J i wsp. Biologia wzrostu i rozwoju trzech gatunków czarnuszki (Nigella sp.). Materiały IV Ogólnopolskiej Konferencji Naukowej nt. „Biologia kwitnienia roślin i alergie pyłkowe”. Wyd AR, Lublin 2003; 63-4.
21. Zohary M. The genus Nigella (Ranunculaceae) a taxonomic revision. Plant Systemat Evol 1983; 142:71-107.
22. Wolski T, Najda A, Wolska-Gawron K. Czarnuszka siewna (Nigella sativa L.) – zawartość i skład lipidów oraz olejków eterycznych występujących w nasionach. Post Fitoter 2017; (3):235-41.
23. Polska Norma. Surowce zielarskie. Pobieranie próbek i metody badań. PN-91 R-87019, 1991.
24. Wierciński J. Przewodnik do ćwiczeń z instrumentalnej analizy chemicznych składników żywności. Wyd AR, Lublin 1999; 189.
25. Farmakopea Polska X, I. Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, PTF Warszawa 2014.
26. Wolski T, Najda A, Mardarowicz M. Analiza GC/MS olejków eterycznych otrzymanych z trzech odmian selera naciowego (Apium graveolens L. var. dulce Mill./Pers.). Annales UMCS, sec. EEE, Horticultura 2001; 9:203-11.
27. Chmiel H. Uprawa roślin ozdobnych. PWRiL, Warszawa 2000; 242-3.
28. Laskowska H, Karczmarz K. Czarnuszka damasceńska – ceniona roślina do kompozycji trwałych. OWK 2001; 23:34-5.
29. Kozłowski J. Czarnuszka siewna i gatunki jej pokrewne. Wiad Ziel 1990; 32(7):19-20.
30. Nowak J. Uprawa roślin na suche bukiety. Uprawa i wykorzystanie roślin na suche bukiety. Materiały z Konferencji Instytutu Sadownictwa i Kwiaciarstwa. Skierniewice 1995; 12-3.
31. Korohoda J. Produkcja nasion roślin ozdobnych. PWRiL, Warszawa 1972; 113-4.
32. Łukasiewicz G. Zielarstwo. Rośliny uprawiane z bezpośredniego siewu nasion w polu. Hortpress, Warszawa 1999; 127-8.
33. Góra J. Oleje roślinne stosowane w kosmetykach. Aromaterapia 1997; 3(9):13-8.
34. Brud WS, Konopacka-Brud I. Pachnąca apteka – tajemnice aromaterapii. Pagina, Warszawa 2001; 138-45.
35. Klimek R. Olejki eteryczne. WPLiS, Warszawa 1957; 297.
36. Roth L, Daunderer M, Koremann K. Giftpflanzen Pflanzengifte. Nikol, Hamburg 1994; 518-9.
37. Wrzeciono U, Zaprutko L. Chemia związków naturalnych. Wyd AM, Poznań 2001; 118-85.
38. Kołodziejczyk A. Naturalne związki organiczne. PWN, Warszawa 2003; 290-533.
39. Steinegger E, Hänsel R. Lechrbuch der Pharmakognosie und Phytopharmazie. Springer-Verlag, Berlin, Heidetberg, N.Y., London 1988; 258-364.
40. Tillequin Par F, Leconte C, Paris M. Carbures sesquiterpeniques des graines de Nigella damascena. Planta Med 1976; 30:59-61.
41. Dauksas E, Venskutonis PR, Sivik B. Comparison of oil from Nigella damascena seed recovered by pressing, conventional solvent extraction and carbon dioxide extraction. J Food Sci 2002; 67(3):1021-4.
42. Serwa AJ. Tajemnice 400 ziół. Karat, Tarnów 1995; 102-3.
43. Riaz M, Syed M, Chaudhary FM. Chemistry of the medicinal plants of the genus Nigella. Hamdard Med 1996; 39(2):40-5.
44. Wawrzyniak E. Leczenie ziołami. IWZZ, Warszawa 1992.
45. Samochowiec L. Kompendium ziołolecznictwa. Volumed, Wrocław 2002; 118-9.







