*Bogdan Kędzia, Elżbieta Hołderna-Kędzia
Współczesne poglądy na mechanizm przeciwdrobnoustrojowego działania miodu
Contemporary opinions on the mechanism of antimicrobial action of honey
Instytut Włókien Naturalnych i Roślin Zielarskich, Poznań
Dyrektor Instytutu: dr n. ekon. Robert Sobków
Streszczenie
Miód pszczeli wyposażony jest w wiele mechanizmów zabezpieczających go przed rozwojem drobnoustrojów, w tym bakterii, grzybów, wirusów i pierwotniaków. Właściwości te w znacznym stopniu ochraniają pszczoły przed drobnoustrojami chorobotwórczymi. Produkt ten wykorzystuje się z dobrymi efektami do leczenia zakażonych ran, owrzodzeń i oparzeń oraz licznych chorób dermatologicznych wywoływanych przez drobnoustroje. Poza tym miód stosowany jest w celach konserwujących produkty żywnościowe oraz tkanki przeznaczone do przeszczepów. Z przedstawionych danych piśmiennictwa można wnioskować, że do mechanizmów zabezpieczających nierozcieńczony miód przed rozwojem drobnoustrojów należy zaliczyć wysokie ciśnienie osmotyczne, będące wynikiem dużej zawartości cukrów, a także niskie pH spowodowane obecnością kwasów organicznych. Natomiast po rozcieńczeniu wodą lub płynami ustrojowymi rolę tę spełnia głównie nadtlenek wodoru powstający w wyniku reakcji enzymatycznej (oksydaza glukozy). W niektórych przypadkach mechanizm ten może być wspomagany przez wysoką zawartość związków fenolowych (kwasy fenolowe i flawonoidy). W miodzie odmianowym manuka czynnikiem antybiotycznym jest metyloglioksal, a w miodzie odmianowym Revamil – peptyd defenzyna-1. Rola lizozymu w miodzie, jako substancji antybiotycznej, jest niejasna i wymaga dalszych szczegółowych badań.
Summary
Bee honey is equipped with many mechanisms to protect it against the development of microorganisms, including bacteria, fungi, viruses and protozoa. These properties significantly protect bees from pathogenic microorganisms. This product is used with positive effects for the treatment of infected wounds, ulcers and burns as well as numerous dermatological diseases caused by microorganisms. More over honey is used for preserving food and tissue intended for transplantation. From the literature data it can be concluded that the mechanisms protecting undiluted honey against the development of microorganisms include high osmotic pressure resulting from a high content of sugars, as well as low pH caused by the presence of organic acids. However, after dilution with water or body fluids, this role is mainly performed by hydrogen peroxide generated by the enzymatic reaction (glucose oxidase). In some cases, this mechanism can be supported by a high content of phenolic compounds (phenolic acids and flavonoids). In variety honey manuka, the antibiotic factor is methylglyoxal, while in the variety honey Revamil – the defensin-1 peptide. The role of lysozyme in honey as an antibiotic substance is unclear and requires further detailed research.

Wprowadzenie
Miód pszczeli wyposażony jest w wiele mechanizmów zabezpieczających go przed rozwojem drobnoustrojów, w tym bakterii, grzybów, wirusów i pierwotniaków. Właściwości te w znacznym stopniu ochraniają pszczoły przed drobnoustrojami chorobotwórczymi (1). Produkt ten wykorzystuje się z dobrymi efektami do leczenia zakażonych ran, owrzodzeń i oparzeń (2) oraz licznych chorób dermatologicznych wywoływanych przez drobnoustroje (3). Poza tym miód stosowany jest w celach konserwujących produkty żywnościowe (4) oraz tkanki przeznaczone do przeszczepów (5).
Czynniki wpływające na antybiotyczne działanie miodu są dość złożone. Można wyróżnić wśród nich trzy grupy: fizyczne, chemiczne i biologiczne. Do czynników fizycznych należy zaliczyć wysokie ciśnienie osmotyczne, będące wynikiem dużej zawartości cukrów w miodzie, a także niskie pH spowodowane obecnością kwasów organicznych. Czynniki chemiczne to przede wszystkim nadtlenek wodoru powstający w wyniku reakcji enzymatycznej (oksydaza glukozy), a także występujący w miodzie manuka metyloglioksal oraz w niektórych odmianach miodów _ wysoka zawartość związków fenolowych, w tym kwasów fenolowych i związków flawonoidowych. Natomiast do czynników biologicznych zalicza się peptydy – lizozym i defenzynę-1, prawdopodobnie tę samą substancję, tylko różnie nazywaną (6-8).
Czynniki fizyczne
Ciśnienie osmotyczne
Zawartość cukrów w miodach naturalnych, zarówno nektarowych, jak i spadziowych, mieści się w granicach 65-87% (średnio 77%). Średnia zawartość glukozy kształtuje się na poziomie 34%, fruktozy – 39%, sacharozy – 1,6%, a innych cukrów, głównie maltozy i melecytozy, na poziomie 2,4% (9). Wysoka zawartość cukrów w miodzie, a co za tym idzie wysokie ciśnienie osmotyczne, rzędu 500 Pa (10), stwarzają niekorzystne warunki dla rozwoju drobnoustrojów.
Przeżywalność drobnoustrojów w miodzie w warunkach naturalnych jest zróżnicowana (1, 11). Wegetatywne formy chorobotwórczych bakterii Gram-dodatnich (Staphylococcus aureus, Streptococcus pneumoniae, Enterococcus faecalis) oraz bakterii Gram-ujemnych (Escherichia coli, Salmonella sp., Shigella sp.) przeżywają w miodzie od 8 godz. do 3 tyg. Natomiast przetrwalniki laseczek tlenowych (Bacillus cereus) i beztlenowych (Clostridium perfringens, C. botulinum, C. difficile) chorobotwórczych dla człowieka mogą przeżywać w miodzie w temp. 25°C przez kilka miesięcy, a w temp. 4°C nawet przez lata. Jednak w tych warunkach nie mogą one kiełkować i przechodzić w formy wegetatywne (12).
Zjawisko to lepiej charakteryzuje tzw. aktywność wodna (aw) (10). Jest to miernik możliwości wykorzystywania wody przez drobnoustroje. Aktywność wodna czystej wody wynosi 1,00, 2% roztworu miodu – 0,99, 12% roztworu miodu – 0,94, 20% roztworu miodu – 0,70, a aktywność wodna nierozcieńczonego miodu zbliżona jest do wartości 0,60 (6). Dla przykładu aktywność wodna 31 miodów hiszpańskich mieściła się w granicach 0,55-0,60 (13).
W tej sytuacji w miodzie nie mają możliwości rozwoju bakterie (aw w granicach 0,91-0,98), grzyby drożdżoidalne (aw na poziomie 0,88), grzyby pleśniowe (aw na poziomie 0,80) oraz pleśnie kserofilne (np. Aspergillus glaucus) (aw na poziomie 0,65) (6, 14, 15). Natomiast w miodzie mogą rozwijać się w sprzyjających warunkach drożdże osmofilne (np. Saccharomyces rouxii, Zygosaccharomyces mellis), dla których aktywność wodna oscyluje w granicach 0,60 (15).
Oznacza to, że w nierozcieńczonym miodzie przeżywanie drobnoustrojów jest bardzo utrudnione. Formy wegetatywne bakterii ulegają w takim środowisku szybkiemu odwodnieniu, wskutek czego giną. Grzyby drożdżoidalne mogą przeżywać w miodzie przez długi czas, ale nie mają szans na rozmnażanie i ich liczba w przechowywanym produkcie maleje. Również przetrwalniki bakteryjne i zarodniki pleśni w środowisku miodu ulegają powolnemu wymieraniu. Tylko drożdże osmofilne, przy zawartości wody powyżej 20%, mogą rozwijać się w tym produkcie (1).
Praktycznie wzrost bakterii, dzięki wysokiej zawartości cukrów, hamowany jest jeszcze w 20% roztworach miodu. Pleśnie kserofilne rosną w 50-60% roztworach miodu, a drożdże osmofilne zdolne są do wzrostu nawet w miodzie zawierającym powyżej 20% wody (6, 10, 14, 15).
Odczyn środowiska (pH)
Dodatkowym czynnikiem uniemożliwiającym rozwój drobnoustrojów w miodzie jest niskie pH tego produktu. Jest ono wynikiem obecności w miodzie wielu kwasów organicznych, zarówno alifatycznych, jak i aromatycznych. Wraz z aminokwasami i kwasami fenolowymi warunkują one wysoką kwasowość miodu.
Według Bogdanova (16) kwasowość ogólna miodów szwajcarskich kształtowała się w granicach 8,9-38,0 mEq/kg (średnio 20,4 mEq/kg). Natomiast Rodriguez i wsp. (17) stwierdzili, że kwasowość ogólna miodów meksykańskich waha się od 13,3 do 46,8 mEq/kg (średnio 30,9 mEq/kg). Z kolei kwasowość ogólna miodów polskich wynosi od 17,7 do 48,5 mEq/kg (średnio 34,0 mEq/kg) (18).
Do ważniejszych kwasów alifatycznych występujących w miodzie zalicza się kwasy: glukonowy, bursztynowy i cytrynowy, a z kwasów aromatycznych kwasy: benzoesowy, cynamonowy i abscyzynowy. Z wolnych aminokwasów w największej ilości w miodzie występują prolina i fenyloalanina. Wśród najczęściej spotykanych kwasów fenolowych wymienia się kwasy: chlorogenowy, kawowy i ferulowy (9).
Bogdanov (16) podaje, że pH miodów szwajcarskich mieści się w granicach 3,4-5,4 (średnio 4,1). Dla miodów hiszpańskich (13) wartości te zawierają się w granicach pH od 3,7 do 4,1 (średnio 4,0), dla miodów meksykańskich (17) w granicach od 3,5 do 5,0 (średnio 3,8), a dla miodów krajowych (18) w granicach od 4,0 do 4,3 (średnio 4,2).
W świetle powyższych danych należy zaznaczyć, że najmniejsze pH, przy którym rośnie jeszcze większość bakterii chorobotwórczych, takich jak ziarniaki Gram-dodatnie – Staphylococcus aureus, Enterococcus faecalis, oraz pałeczki Gram-ujemne – Escherichia coli i Pseudomonas aeruginosa, mieści się w przedziale 4,5-5,7 (10). Minimalne pH dla bakterii uczestniczących w rozkładzie żywności kształtuje się z kolei w granicach 4,2-4,5. To sprawia, że większość bakterii nie ma szans na rozmnażanie się, a nawet na przeżycie w takim produkcie jak naturalny miód pszczeli (1).
Czynniki chemiczne
Nadtlenek wodoru
Wysokie stężenie cukrów i kwaśny odczyn środowiska w pełni uzasadniają tylko przeciwdrobnoustrojową aktywność naturalnego nierozcieńczonego miodu.
W 1966 roku White (19) zauważył, że po rozcieńczeniu miodu wodą można uzyskać znacznie wyższą jego aktywność wobec badanych drobnoustrojów niż tę, która wynika z wysokiego stężenia cukrów. W trakcie prowadzonych badań wykrył on enzym – oksydazę glukozy, który sam nie wykazywał właściwości przeciwdrobnoustrojowych, natomiast katalizował utlenianie glukozy do laktonu kwasu glukonowego (glukonolaktonu) w obecności tlenu atmosferycznego. Okazało się, że lakton ten po przyłączeniu cząsteczki wody przechodzi następnie w kwas glukonowy. W reakcji tej jako produkt uboczny powstaje nadtlenek wodoru (H2O2) (ryc. 1) – związek o silnych właściwościach przeciwdrobnoustrojowych.
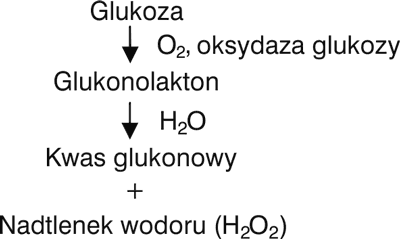
Ryc. 1. Mechanizm powstawania nadtlenku wodoru z glukozy (wg 19)
Nadtlenek wodoru działa zarówno na bakterie i grzyby, jak również na wirusy oraz pierwotniaki. Już w stężeniu 3-10 μg/ml (przy pH 5,0) działa bakteriostatycznie wobec chorobotwórczych Gram-dodatnich ziarniaków Staphylococcus aureus, Gram-ujemnych pałeczek Pseudomonas aeruginosa, grzybów drożdżoidalnych Candida albicans oraz grzybów pleśniowych Aspergillus fumigatus (20, 21).
Następnie Dustman (22) stwierdził, że w miodzie nierozcieńczonym opisana powyżej reakcja zachodzi bardzo wolno. Natomiast po rozcieńczeniu miodu wodą wytwarzanie nadtlenku wodoru zachodzi bardzo szybko. Jeśli na przykład w 1 g nierozcieńczonego miodu ilość wytwarzanego nadtlenku wodoru wynosi 3 μg/godz., to po rozcieńczeniu go wodą ilość ta wzrasta w granicach 17-662 μg/godz. A zatem aktywność antybiotyczna rozcieńczonego miodu może wzrastać od 6 do 220 razy w porównaniu z miodem nierozcieńczonym.
Dustman (22) wykazał ponadto, że występuje duże zróżnicowanie miodów w zależności od zdolności wytwarzania nadtlenku wodoru. I tak do miodów wytwarzających niewielkie ilości H2O2 można zaliczyć miód akacjowy, wrzosowy i rzepakowy, natomiast do miodów o dużej zawartości tego związku należą: miód kasztanowy i miód ze spadzi iglastej (tab. 1).
Tab. 1. Ilość wytwarzanego nadtlenku wodoru w miodach odmianowych po rozcieńczeniu ich wodą (wg 22)
| Odmiana miodu | Liczba badanych prób | Ilość wytworzonego nadtlenku wodoru (μg/g) |
| akacjowy | 3 | 18-32 |
| wrzosowy | 3 | 29-34 |
| rzepakowy | 4 | 42-125 |
| kasztanowy | 5 | 120-605 |
| ze spadzi iglastej | 5 | 284-663 |
Oksydaza glukozy jest enzymem wrażliwym na ciepło. Miód ogrzewany przez 15 min w temp. 60°C, 5 min w temp. 80°C lub wystawiany na godzinę na słońce może całkowicie utracić swoje właściwości antybiotyczne (23). Ponadto nadtlenek wodoru obecny w miodzie i jego roztworach może ulegać rozkładowi na wodę i tlen pod wpływem enzymu katalazy. Występuje ona niekiedy w miodach nektarowych i pochodzi z pyłku kwiatowego. Miody zawierające katalazę odznaczają się niską aktywnością antybiotyczną lub są jej pozbawione całkowicie (19, 23).
Z danych przedstawionych przez Allena i wsp. (24) wynika, że aktywność miodu rozcieńczonego wodą zależy głównie od obecności w nim nadtlenku wodoru. Na 180 próbek rozcieńczonego miodu, do którego wprowadzono enzym katalazę, tylko 11 z nich (6,1%) nadal odznaczało się aktywnością antybiotyczną. W pozostałych przypadkach aktywność ta uległa całkowitemu unieczynnieniu. Świadczy to niezbicie o antybiotycznym działaniu nadtlenku wodoru, wytworzonemu pod wpływem oksydazy glukozy. Natomiast w przypadku rozcieńczonych próbek miodu, wykazujących aktywność antybiotyczną, mimo dodania katalazy, prawdopodobnie zadziałały inne mechanizmy obrony przeciwdrobnoustrojowej, takie jak metyloglioksal, związki fenolowe lub peptyd defenzyna-1.
Metyloglioksal
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Snowdown JA, Clivier DO. Microorganisms in honey. Int J Food Microbiol 1996; 31:1-26.
2. Al-Waili NS, Salom K, Al-Ghamdi AA. Honey for wound healing, ulcers, and burns; data supporting its use in clinical practice. Sci World J 2011; 11:766-87.
3. Burlando B, Cornara L. Honey in dermatology and skin care: a review. J Cosmet Dermatol 2013; 12(4):306-13.
4. Lusby PE, Coombes AL, Wilkinson JM. Bactericidal activity of different honeys against pathogenic bacteria. Arch Med Res 2005; 36:464-7.
5. Gupta M. Preservation of split skin grafts in honey: a preliminary study. Indian J Surg 1977; 11:591-8.
6. Molan PG. The antibacterial activity of honey. 2. Variation in the potency of the antibacterial activity. Bee World 1992; 73(2):59-76.
7. Al-Waili NS, Salom K, Butler G i wsp. Honey and microbial infections: a review supporting the use of honey for microbial control. J Med Food 2011; 14(10):1079-96.
8. Kwakman PHS, Zaat SAJ. Antibacterial components of honey. Life 2012; 64(1):48-55.
9. Kędzia B, Hołderna-Kędzia E. Miód. Skład i właściwości biologiczne. Przeds Wyd Rzeczpospolita SA, Warszawa 2008; 51-64.
10. Horubała A. Podstawy przechowywania żywności. PWN, Warszawa 1975; 26-38, 72-5.
11. Tysset C, Durand C. On the survival of some Gram-negative, non-sporulated bacteria in commercial honey. Bull Acad Vet Fr 1973; 46:191-6.
12. Kukubo Y, Jinbo K, Kaneko S i wsp. Prevalance of spore-forming bacteria in commercial honey. Ann Rep Tokyo Metr Res Lab Health 1984; 35:192-6.
13. Gallardo-Chancón JJ, Caselles M, Izguierdo-Pulido M i wsp. Inhibitory activity of monofloral and multifloral honeys against bacterial pathogens. J Apicult Res Bee World 2008; 47(2):131-6.
14. Müller G. Podstawy mikrobiologii żywności. PWN, Warszawa 1983; 113-7.
15. Rhodes MF (ed.). Food mycology. Hall and Co, Boston 1979; 159-63.
16. Bogdanov S. Nature and origin of the antibacterial substances in honey. Lebens Wiss Technol 1997; 30:748-53.
17. Rodriguez B, Mendoza S, Itturiga MH i wsp. Quality parameters and antioxidant and antibacterial properties of some Mexican honeys. J Food Sci 2012; 77(1):C121-7.
18. Rybak-Chmielewska H, Szczęsna T. Charakterystyka krajowych miodów odmianowych. [W:] Rybak-Chmielewska H (red.). Podstawowe zagadnienia jakości miodu. Wyd Inst Sadown Kwiac Oddz Pszczeln, Puławy 1996; 16-22.
19. White JW. Inhibine and glucose oxidase in honey – a review. Am Bee J 1966; 106:214-6.
20. Zander E, Koch A. Der Honig. Verlag Eugen Ulmer, Stuttgart 1975; 94-6.
21. Kramer A, Hetmanek R, Weuffen W i wsp. Wasserstoffperoxide. [In:] Handbuch der Antiseptik, Band II. VEB Verlag Volk und Gesundheit, Berlin 1987; 447-91.
22. Dustman JH. Messung von Wasserstoffperoxid und Enzymaktivität in mitteleneuropäischen Honigen. Z Bienenforsch 1967; 9:66-73.
23. Gonnet M. Naturalnyje antibioticzeskije faktory, sodierżaszcziesja w miedie. [In:] Produkty pczełowodstwa – piszcza, zdorowie, krasota. Izd. Apimondii, Bucharest 1988; 33-7.
24. Allen KL, Molan PC, Reid GM. The variability of the antibacterial activity of honey. Apiacta 1991; 4:114-21.
25. Adams CJ, Boult CH, Deadman BJ i wsp. Isolation by HPLC and characterization of the bioactive fraction of New Zealand manuka (Leptospermum scoparium) honey. Carbohydr Res 2008; 343:651-9.
26. Mavric E, Wittman S, Barth G i wsp. Identification and quantification of methylglyoxal as the dominant antibacterial constituent of manuka (Leptospermum scoparium) honeys from New Zealand. Mol Nutr Food Res 2008; 52:483-9.
27. Atrott J, Henle T. Methylglyoxal in manuka honey – correlation with antibacterial properties. Czech J Food Sci 2009; 27:5163-5.
28. Kwakman PHS, Velde AA, Boer L i wsp. How honey kills bacteria. FASEB J 2010; 24:2576-82.
29. Allen KL, Hutchinson G, Molan PC. The potential for using honey to treat wounds infected with MRSA and VRE. First World Wound Healing Congress, 10-13 September 2000, Melbourne (Australia). Handbook and Abstracts: 86.
30. Brady NF, Molan PC. Antibacterial activity of honey against enteropathogenic bacteria. Univ Waikato, Hamilton 1997; 1-17.
31. Cooper RA, Halas E, Molan PC. The efficacy of honey in inhibiting strains of Pseudomonas aeruginosa from infected burns. J Burn Care Rehabil 2002; 23:366-70.
32. Cooper RA, Wigley P, Burton NF. Susceptibility of multiresistant strains of Burkholderia cepacia to honey. Lett Appl Microbiol 2000; 31:20-4.
33. Somal NA, Coley KE, Molan PC i wsp. Susceptibility of Helicobacter pylori to the antibacterial activity of manuka honey. JR Soc Med 1994; 87:9-12.
34. Hammond EN, Donhor ES. Antibacterial effect of manuka honey on Clostridium difficile. BMC Res Not 2013; 6:188-92.
35. Irish J, Carter DA, Shokohi T i wsp. Honey has antifungal effect against Candida species. Med Mycol 2006; 44:289-91.
36. Brady ANF, Molan PC, Harfoot CG. The sensitivity of dermatophytes to the antimicrobial activity of manuka honey and other honey. Pharm Sci 1996; 2:471-3.
37. Kędzia B, Hołderna-Kędzia E. Aktywność antybiotyczna miodu manuka i jego działanie na drobnoustroje chorobotwórcze dla człowieka. Post Fitoter 2015; 16(4):258-62.
38. Stephens JM, Schlothauer RC, Morris BD i wsp. Phenolic compounds and methylglyoxal in some New Zealand manuka and hanuka honeys. Food Chem 2010; 120:78-86.
39. Martos I, Cossentini M, Ferveres F i wsp. Flavonoid composition of Tunisian honeys and propolis. J Agric Food Chem 1997; 45:2854-9.
40. Kołoczek H, Kaszycki P, Świderski A i wsp. Wsparcie produkcji i zbytu miodu – ocena zawartości antyutleniaczy w miodach polskich. Projekt badawczy. Apipol-Farma, Myślenice 2005.
41. Schneider M, Coyle S, Warnock M i wsp. Anti-microbial activity and composition of Manuka and Portobello honey. Phytother Res 2013; 27:1162-8.
42. Rodriguez BA, Mendoza S, Itturiga M i wsp. Quality parameters and antioxidant and antibacterial properties of some Mexican honeys. J Food Sci 2012; 77(1):C121-7.
43. Kishore RK, Halim AS, Syazana MSN i wsp. Tualang honey has higher phenolic content and greater radical scavenging activity compared with other honey sources. Nutr Res 2011; 31:322-5.
44. Andrade P, Ferveres F, Amaral MT. Analysis of honey phenolic acids by HPLC its application to honey botanical characterization. J Liq Chrom Rel Technol 1997; 20:2281-8.
45. Tom?s-Barber?n FA, Martos I, Ferveres F i wsp. HPLC flavonoid profiles as markers for the botanical origin of European unifloral honeys. J Sci Food Agric 2001; 81:485-96.
46. Dimitrova B, Gerrenova R, Anklam E. Analysis of phenolic acids in honeys of different floral origin by solid-phase extraction and high-performance liquid chromatography. Photochem Anal 2007; 18:24-32.
47. Kędzia B, Hołderna-Kędzia E. Działanie przeciwdrobnoustrojowe roślinnych pochodnych fenolu. Post Fitoter 2012; (3):151-5.
48. Kassim M, Achoni M, Mustafa MR i wsp. Ellagic acid, phenolic acids, and flavonoids in Malaysian honey extracts demonstrate in vitro anti-inflammatory activity. Nutr Res 2010; 30:650-9.
49. Hołderna-Kędzia E, Mścisz A, Kędzia B. Badania nad aktywnością antybiotyczną i zawartością flawonoidów w miodach odmianowych. Mat XL Nauk Konf Pszczel Puławy 2003; 127.
50. Hołderna-Kędzia E, Kędzia B. Antybiotyczne działanie miodu. IX Kraj Nauk-Techn Konf Pszczel, Częstochowa 2003; 83-95.
51. Mohrig W, Messner B. Lyzozym als antibakterielles Agents im Bienenhonig und Bienengift. Acta Biol Med Germ 1968; 21:85-90.
52. Nagornaja IM, Lewczenko IA. Lizozim – baktericidnyj component pczelinogo mieda. Apiterapia i pczełowodstwo. Wyd Alna Litera, Wilnjus 1993; 4-9.
53. Bodnarczuk LI, Nagornaja IM, Lewczenko IA. Nowoje ob antibakterialnych swojstwach mieda. Pczełowodstwo 1995; (4):48-9.
54. Bodnarczuk L, Nagornaya I, Levchenko I. Factors that determine lysozyme level in the honey. Mat XL Nauk Konf Pszczel, Puławy 2003; 110-1.
55. Bodnarczuk LI, Nagornaya IM, Levchenko IA i wsp. Wpływ pokarmu białkowego na ilość lizozymu w gruczołach potylicznych pszczół. Przegl Pszczel 2006; (3):34-5.
56. Trziszka T, Kopeć W. Lizozym i jego charakterystyka. Właściwości biologiczne i fizykochemiczne. Przem Spoż 1997; 51(1):41-3.
57. Fujiwara S, Imai J, Fujiwara M i wsp. A potent antibacterial protein in royal jelly. J Biol Chem 1990; 265:11333-7.
58. Bilikova K, Hanes J, Nordhoff E i wsp. Apisimin, a new serine-valine-rich peptide from honeybee (Apis mellifera L.) royal jelly: purification and molecular characterization. FEBS Lett 2002; 528:125-9.
59. Fontana R, Meudes MA, Monson de Souza B i wsp. Jelleins: a family of antibacterial peptides from royal jelly of honeybees (Apis mellifera). Peptides 2004; 25:919-28.
60. Kwakman PHS, Velde AA, Boer L i wsp. Two major medicinal honeys have different mechanisms of bactericidal activity. PLOS ONE 2011; 6(3):e17709.
61. Kwakman PHS, Van der Akker JPC, Güglü A i wsp. Medical-grade honey kills antibiotic-resistant bacteria in vitro and eradicates skin colonization. Clin Infect Dis 2008; 46:1677-82.
62. Kwakman PHS, Velde AA, Boer L i wsp. How honey kills bacteria. FASEB J 2010; 24:2576-82.
63. Kwakman PHS, Boer L, Ruyter-Spira CP i wsp. Medical-grade honey enriched with antimicrobial peptides has enhanced activity against antibiotic-resistant pathogens. Eur J Clin Microbiol Infect Dis 2011; 30:251-7.

