© Borgis - Postępy Nauk Medycznych 12/2010, s. 963-967
*Małgorzata Sikora-Frąc
Hiperglikemia w ostrych zespołach wieńcowych u pacjentów z cukrzycą i bez cukrzycy
Hyperglycaemia in acute coronary syndromes in diabetics and non-diabetics
Klinika Kardiologii Centrum Medycznego Kształcenia Podyplomowego, Szpital Grochowski, Warszawa
Kierownik Kliniki: prof. dr hab. med. Andrzej Budaj
Streszczenie
Podwyższony poziom glukozy u pacjentów z cukrzycą, jak i hiperglikemia wywołana stresem u osób bez cukrzycy są związane z pogorszeniem rokowania w ostrym zespole wieńcowym. Wykazano, że wśród chorych bez cukrzycy z podwyższonymi poziomami glukozy (> 110 mg/dl) wzrasta ryzyko zgonu, niewydolności serca i wstrząsu kardiogennego. Dodatnia korelacja z incydentami sercowo-naczyniowymi występuje zarówno przy podwyższonej glikemii na czczo, jak i podwyższonej średniej glikemii w ciągu pierwszej doby zawału serca. Pomimo wielu badań nie wiadomo czy hiperglikemia w zawale serca jest przyczyną gorszego rokowania, czy objawem występującym u bardziej chorych pacjentów. Ostra hiperglikemia jest zjawiskiem spowodowanym przez zmiany hormonalne i aktywację adrenergiczną. Wykazano, że podwyższona glikemia wpływa negatywnie na funkcję śródbłonka, leukocytów i płytek krwi. Nie ma jednoznacznie określonej wartości glikemii, do której należy dążyć po stwierdzeniu ostrej hiperglikemii, u pacjentów z ostrym zespołem wieńcowym z cukrzycą i bez cukrzycy. Europejskie Towarzystwo Kardiologiczne i Polskie Towarzystwo Diabetologiczne rekomendują ścisłą kontrolę glikemii, ale badania dotyczące intensywnego leczenia insuliną w zawale serca nie dały jednoznacznych wyników i miały wiele ograniczeń. W pierwszej dobie hospitalizacji zaleca się zastosowanie insuliny, natomiast leczenie hipoglikemizujące w kolejnych dobach hospitalizacji powinno zapewnić wartości glikemii w granicach 100-180 mg/dl. Rodzaj stosowanego leczenia uzależniony jest od dobowego zapotrzebowania na insulinę i istniejących powikłań ze strony innych narządów.
Summary
Elevated glucose blood concentration in diabetic patients and stress hyperglyceamia in non-diabetic patients are associated with worse outcome in acute coronary syndrome. Stress hyperglyceamia is associated with an increased mortality, heart failure and cardiogenic shock in patients with acute coronary syndrome without diabetes mellitus. Several studies have shown positive correlation between admission hyperglyceamia, elevated fasting glucose level or hyperglyceamia during first 24 hours of acute myocardial infarction and cardiovascular events. It is still not known whether hyperglyceamia is a marker of severity of underlying diseases or is a cause of poor outcome. Acute hyperglyceamia is caused by hormonal changes and adrenergic activation. Hyperglyceamia has been shown to have negative effects on the endothelial cells, leukocytes and platelets. The target glucose concentration during an acute coronary syndrome in diabetic and non-diabetic patients are not clearly defined. The European Society of Cardiology and the Polish Society of Diabetology recommend strict glucose control but clinical trials of intensive insulin treatment in patients with acute myocardial infarction have shown inconsistent results and have had numerous limitations. Insulin treatment is recommended during the first 24 hours of hospitalization. Implementation of treatment in order to achieve and maintain blood glucose level between 100 and 180 mg/dl during next days is associated with vascular complications and the increased daily insulin requirement.

WPROWADZENIE
Zaburzenia gospodarki węglowodanowej w zawale serca są znane od bardzo dawna. Pierwsze doniesienie dotyczące glikozurii u pacjentów bez cukrzycy (DM) ze świeżym zawałem serca (AMI) pochodzi z 1931 roku. W kolejnych dekadach ubiegłego wieku na pytanie, czy hiperglikemia w AMI serca jest zjawiskiem przejściowym spowodowanym przez zmiany hormonalne i aktywację adrenergiczną próbowało odpowiedzieć wielu badaczy, między innymi procesy te analizował profesor Leszek Ceremużyński (1-6). W pracy opublikowanej w 1974 roku wykazano, że u pacjentów z AMI bez DM podwyższony poziom adrenaliny we krwi i moczu współistnieje z obniżonym stężeniem insuliny pomimo podwyższonego stężenia glikemii (5). W innych badaniach stwierdzono ponadto, że w ciężkim AMI oprócz stężenia katecholamin wpływ na hiperglikemię ma wskaźnik insulina/glukagon, a nie samo stężenie glukagonu (4, 6). Oprócz wymienionych powyżej hormonów, w sytuacji stresowej (jaką jest AMI) dochodzi także do zwiększonego uwalniania glikokortykoidów, hormonów tarczycy i hormonu wzrostu. Wynikiem tych procesów jest wzrost stężenia glukozy we krwi w następstwie stymulacji glukoneogenezy, hamowania wydzielania insuliny i zwiększenia insulinooporności (ryc. 1). Hiperglikemia towarzysząca stresowi może też być wskaźnikiem rozpoczynającej się niewydolności komórek beta trzustki w warunkach wzmożonego zapotrzebowania na insulinę.
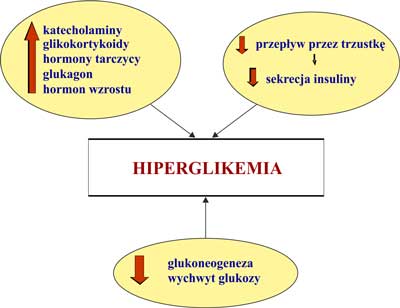
Ryc. 1. Ostry zawał serca – zmiany hormonalne i metaboliczne.
W wyniku hiperglikemii i względnego niedoboru insuliny spada dopływ glukozy do kardiomiocytów i dochodzi do spowolnienia glikolizy beztlenowej, która w warunkach niedokrwienia stanowi główne źródło energii dla mięśnia sercowego. Dodatkowo niedobór insuliny powoduje nasilenie lipolizy i wzrost uwalniania wolnych kwasów tłuszczowych, które dla zdrowego serca stanowią substrat energetyczny, natomiast są toksyczne dla niedokrwionego mięśnia sercowego (ryc. 2).
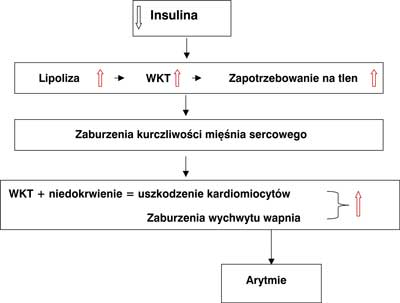
Ryc. 2. Mechanizm uszkodzenia mięśnia sercowego w czasie ostrego niedokrwienia.
WKT – wolne kwasy tłuszczowe
Ostra hiperglikemia indukuje w organizmie człowieka wiele niekorzystnych procesów. Najważniejszy z nich to nasilenie stresu oksydacyjnego, którego konsekwencją jest między innymi zaburzenie funkcji śródbłonka. Dochodzi do wzrostu uwalniania endoteliny i wtórnie do wazokonstrykcji, wzmożonej proliferacji komórek śródbłonka, zmniejszenia jego właściwości antykoagulacyjnych, nasilenia odkładania lipidów w ścianach naczyń i ich zwiększonej przepuszczalności. Nagły wzrost stężenia glukozy we krwi może także powodować niestabilność blaszek miażdżycowych wskutek uruchomienia apoptozy komórek endotelium. Inne niekorzystne efekty hiperglikemii to: wzrost produkcji białek adhezyjnych a przez to wzrost adhezji leukocytów i płytek krwi, nasilenie reakcji zapalnych oraz apoptoza kardiomiocytów.
Hiperglikemia a rokowanie w ostrych zespołach wieńcowych
W ostrych zespołach wieńcowych (ACS) zła kontrola glikemii u pacjentów z DM, jak i hiperglikemia wywołana stresem u osób bez DM jest związana z pogorszeniem rokowania. Oceniono zarówno związek pomiędzy wartościami glukozy w surowicy krwi przy przyjęciu a rokowaniem w krótkim okresie czasu (najczęściej 30 lub 180 dni po AMI) u chorych z i bez DM, jak i rokowanie długoterminowe u pacjentów z DM. Capes i wsp. dokonali metaanalizy 15 badań i ocenili ryzyko śmiertelności wewnątrzszpitalnej oraz ryzyko wystąpienia niewydolności serca u pacjentów z AMI i bez DM, u których stwierdzono ostrą hiperglikemię w momencie hospitalizacji (7).
Okazało się, że wśród chorych bez DM ze stężeniem glukozy pomiędzy 110 a 143 mg/dl (6,1-8 mmol/L) ryzyko zgonu było 3,9 razy większe w porównaniu z pacjentami z niższymi poziomami glukozy. Wartości glikemii wyższe niż 180 mg/dl (10 mmol/L) wiązały się z częstszym występowaniem niewydolności serca i wstrząsu kardiogennego. Natomiast pacjenci z DM, którzy mieli poziom glukozy ≥ 180 do 196 mg/dl (10-11 mmol/L), także mieli większe ryzyko zgonu w porównaniu z cukrzykami z normoglikemią (1,7 razy) ale to ryzyko było mniejsze niż u osób bez DM. W innej pracy Goyal i wsp. przestudiowali dane pacjentów włączonych do CARDINAL study i zbadali zależność pomiędzy wyjściowym poziomem glikemii oraz jej zmianami w ciągu pierwszych 24 godzin AMI a śmiertelnością 30- i 180-dniową u chorych bez cukrzycy. Zarówno wysokie wyjściowe stężenia glukozy w surowicy krwi, jak i zła kontrola glikemii w ciągu pierwszej doby pobytu w szpitalu były związane z podwyższonym ryzykiem zgonu (8).
Podobne informacje przyniosła opublikowana w 2009 roku, także przez Goyala i wsp., analiza badań CREATE-ECLA i OASIS-6. Do obu badań włączono łącznie ponad 30 tysięcy pacjentów z AMI z uniesieniem odcinka ST (STEMI) i podzielno ich na dwie podgrupy w zależności od obecności lub braku DM; każdą z tych podgrup podzielono jeszcze w zależności od średnich wartości glikemii stwierdzanych w czasie pierwszej doby hospitalizacji (< 144 mg/dl i ≥ 144 mg/dl). Średni poziom glukozy ≥ 144 mg/dl korelował z podwyższoną śmiertelnością 30-dniową zarówno wśród chorych z DM (13,7%), jak i bez DM (13,2%) w porównaniu z chorymi z glikemią < 144 mg/dl (odpowiednio 8,4% i 5 %) (9). Suleiman i wsp. wykazali zaś korelację pomiędzy podwyższonymi wartościami glukozy na czczo a wzrostem ryzyka zgonu u pacjentów z AMI bez DM. Dane pochodzące z rejestru GRACE potwierdzają w/w zależność (10). Ryzyko zgonu w obserwacji 30- i 180-dniowej były wyraźnie wyższe u chorych z wysokimi stężeniami glukozy na czczo: 1,71 – dla glikemii 126-199 mg/dl i 2,93 – dla glikemii ≥ 300 mg/dl, ale nie dla wartości pomiędzy 200-299 g/dl (1,08), co pozostaje trudne do wyjaśnienia.
Prawdopodobnym mechanizmem w wyniku, którego ostra hiperglikemia pogarsza rokowanie pacjentów z ACS, jest dysfunkcja śródbłonka prowadząca do zaburzeń przepływu wieńcowego. W badaniu Timmera i wsp. 70% pacjentów ze STEMI przy przyjęciu miało poziom glukozy ≥ 140 mg/dl, a tylko u 14% stwierdzono w wywiadzie DM. Chorzy z hiperglikemią mieli znamiennie rzadziej dobry przepływ (TIMI-3) w tętnicach wieńcowych przed zabiegiem przezskórnej interwencji wieńcowej (PCI) w porównaniu z osobami z normoglikemią (12% vs 28%) (11). Ponadto podwyższone stężenie glukozy przy przyjęciu do szpitala korelowały z rozległością zawału serca i przyczyniały się do przyśpieszenia przebudowy lewej komory. Pomimo wielu badań nie jest jednoznaczne czy hiperglikemia przy przyjęciu oraz w czasie 24 godzin od początku hospitalizacji jest przyczyną gorszego rokowania, czy jest objawem występującym u bardziej chorych pacjentów. Bardzo ciekawe są wyniki pracy Kosibrod i wsp., którzy wykazali większą wartość rokowniczą średniego stężenia glukozy w trakcie całego pobytu w szpitalu w porównaniu z glikemią przy przyjęciu u pacjentów z AMI. Śmiertelność wewnątrzszpitalna wzrastała wraz ze wzrostem stężenia glukozy o każde 10 mg/dl powyżej średniej wartości ≥ 120 mg/dl (OR 1,8; P=0,003) i przyjmowała kształt litery J. Odnotowano bardzo dużą śmiertelność wśród chorych z hipoglikemią (< 70 mg/dl) w porównaniu z osobami z normoglikemią (100-109 mg/dl) – OR 6,4 (12).
Analizując 3 badania (TIMI-10A/B, LIMIT-AMI, OPUS-TIMI-16) Pinto i wsp. stwierdzili zależność o kształcie litery U pomiędzy wartościami glikemii a rokowaniem pacjentów ze STEMI. 30-dniowa śmiertelność w grupie badanej wśród osób z hipoglikemią (glukoza < 81mg/dl) wynosiła 4,6%, u pacjentów z normoglikemią (glukoza 82-99 mg/dl) 1%, by wśród chorych z glikemią > 199 mg/dl wzrosnąć do 4,7%. Częstość powtórnych zawałów w obserwacji 30-dniowej wynosiła odpowiednio 10,5%, 4,2% i 7,2% (13). Zależność o kształcie litery U występowała zarówno u pacjentów z DM, jak i bez DM. Ten sam charakter zmian zaobserwowano u chorych z NSTEMI.
Leczenie hiperglikemii w ostrych zespołach wieńcowych
Jak dotąd nie ma jednoznacznej metody postępowania po stwierdzeniu ostrej hiperglikemii u pacjentów hospitalizowanych z powodu ACS z i bez cukrzycy. Nie jest też jasne czy hipoglikemia wtórna do leczenia hipoglikemicznego wpływa na wzrost ryzyka wystąpienia incydentu sercowo-naczyniowego. Ilość informacji dotycząca intensywnego leczenia osób z podwyższonym stężeniem glukozy jest ograniczona. Dane pochodzą z badań dotyczących osób leczonych w oddziałach intensywnej terapii (tylko mały odsetek z nich miało AMI), pacjentów z zawałem serca oraz pacjentów hospitalizowanych w oddziałach internistycznych. Potencjalne korzyści wynikające z leczenia insuliną przedstawiono w tabeli 1.
Tabela 1. Potencjalne korzyści naczyniowe leczenia insuliną.
Rozkurcz naczyń wieńcowych
Poprawa funkcji śródbłonka
Efekt antyoksydacyjny
Efekt przeciwzapalny
Efekt antyagregacyjny
Redukcja stężenia tromboksanów
Obniżenie stężenia tkankowego inhibitora plasminogenu
Wzrost uwalniania prostacykliny
Zahamowanie apoptozy |
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Ceremużyński L: Catecholamines in blood and urine thyroid and adreno-cortical function and insulin levels in myocardial infarction with mild and severe course. Annals of Medical Section of Polish Academy of Science 1970; 15: 111.
2. Tatoń J, Ceremużyński L, Wiśniewska A: Zaburzenia przemiany węglowodanowej w ostrym zawale serca. Pol Arch Med Wewn 1969; 43: 6 -10.
3. Ławecki T, Kuch J, Ceremużyński L et al.: The behaviour of blood sugar and serum insulin (IRI) after oral administration of glucose in different stages myocardial infarction. Acta Diabet Lat 1972; 9: 97.
4. Ławecki J, Ceremużyński L, Rogala H et al.: Badanie zależności pomiędzy poziomem glukagonu i hormonu wzrostu a poziomem glukozy we krwi w zawale serca. Pol Arch Med Wewn 1975; 53: 551.
5. Ceremużyński L, Kuch J, Ławecki J et al.: Adrenergic activity and immunoreactive insulin levels in relation to the clinical course of myocardial infarction. Cor Vasa 1974; 3: 153 - 61.
6. Ławecki J, Ceremużyński L, Rogala H et al.: Relationship between the blood glucagon, growth hormone and glucose levels in myocardial infarction. Polish Medical Science and History Biulletin 1976, XV/IV, No 1.
7. Capes SE, Hunt D, Malmberg K et al.: Stress hyperglycaemia and increased risk of death after myocardial infarction in patients with and without diabetes: a systematic overview. Lancet 2000; 355: 773-78.
8. Goyal A, Mahaffey KW, Garg J et al.: Prognostic significance of the change in glucose level in the first 24h after acute myocardial infarction: results from the CARDINAL study. Eur Heart J 2006; 27: 1289-97.
9. Goyal A, Mehta S, Gerstein H et al.: Glucose level compared with diabetes history in the risk assessment of patients with acute myocardial infarction. Am Heart J 2009; 157: 763 -70.
10. Sinnaeve P, Steg G, Fox A et al.: Association of elevated fasting glucose with increased short-term and 6-month mortality in ST-segment elevation and non-ST-segment elevation acute coronary syndromes. Arch Inntern Med 2009; 169(4): 402-9.
11. Timmer JR, Ottervanger JP, de Boer MJ et al.: Hyperglycemia is an important predictor of impaired coronary flow before reperfusion therapy in ST-segment elevation myocardial infarction. J Am Coll Cardiol 2005; 45: 999.
12. Kosiborod M, Inzucchi SE, Krumholz HM et al.: Glucometrics in patients hospitalized with acute myocardial infarction. Defining the optimal outcomes-based measure of risk. Circulation 2008; 117: 1018-27.
13. Pinto Ds, Skolnick AH, Kirtane AJ et al.: U-shaped relationship of blood glucose with adverse outcomes among patients with ST-segment elevation myocardial infarction. J Am Coll Cardiol 2005; 46: 178.
14. Malmberg K: Prospective randomized study of intensive insulin treatment on long term survival after acute myocardial infarction in patients with diabetes mellitus. DIGAMI (Diabetes Mellitus, Insulin Glucose Infusion in Acute Myocardial infarction) Study Group. BMJ 1997; 314: 1512.
15. Van den Berghe G, Wouters P, Weekers F et al.: Intensive insulin therapy in critically ill patients. N Engl J Med 2001; 345: 1359-67.
16. Kosiborod M, Inzucchi SE, Krumholz HM et al.: Glucose normalization and outcomes in patients with acute myocardial infarction. Arch Intern Med 2009; 169: 438.
17. The NICE-SUGAR study investigators: Finfer S, Blair D, Bellamo R et al.: Intensive versus conventional glucose control in critically ill patients. N Eng J Med 2009; 13: 1283-97.
18. Guidelines on diabetes, pre-diabetes and cardiovascular diseases: executive summary. Task Force Members: Ryden L, Standl E, Bartnik M et al. Eur Heart J 2007; 28: 88-136.
19. Zalecenia kliniczne dotyczące postępowania u chorych na cukrzycę 2009. Czech A, Cypryk K, Czupryniak L et al. Diabetologia doświadczalna i kliniczna,2009; 9: supl. A 1-42.


