© Borgis - Postępy Nauk Medycznych 4/2017, s. 168-176
*Anna Drelich-Zbroja1, Elżbieta Czekajska-Chehab2, Monika Miazga1, Anna Szymańska1, Andrzej Wolski3, Paweł Bernat3, Tomasz Jargiełło1
Znaczenie badań obrazowych w monitorowaniu chorych po wewnątrznaczyniowym leczeniu tętniaków aorty brzusznej
The utility of various imaging modalities in monitoring patients after endovascular treatment of abdominal aortic aneurysms
1Zakład Radiologii Zabiegowej i Neuroradiologii, Uniwersytet Medyczny w Lublinie
Kierownik Zakładu: prof. dr hab. med. Małgorzata Szczerbo-Trojanowska
2Zakład Radiologii i Medycyny Nuklearnej, Uniwersytet Medyczny w Lublinie
Kierownik Zakładu: prof. dr hab. med. Andrzej Drop
3Oddział Chirurgii Naczyniowej, Samodzielny Publiczny Szpital Kliniczny Nr 4 w Lublinie
Kierownik Oddziału: dr hab. med. Andrzej Wolski
Streszczenie
Wstęp. Wewnątrznaczyniowa metoda leczenia tętniaków aorty brzusznej pozwala na leczenie pacjentów, którzy nie kwalifikują się do klasycznej operacji chirurgicznej z powodu wysokiego ryzyka operacyjnego, będącego wynikiem zaawansowanych chorób układu krążenia i oddechowego. Aktualnie już niemal połowa chorych z tętniakami aorty brzusznej leczona jest metodą wewnątrznaczyniową, a w pojedynczych ośrodkach odsetek ten sięga nawet 70%. Metoda ta obarczona jest jednak powikłaniami, takimi jak: powiększenie worka tętniaka, zaciek, migracja protezy, niedrożność lub zwężenie ramienia głównego czy odnóg biodrowych. Celem wykluczenia lub potwierdzenia powikłań i oceny częstości ich występowania chorzy po implantacji stentgraftu muszą być poddawani obrazowym badaniom kontrolnym.
Cel pracy. Ocena znaczenia badań obrazowych w monitorowaniu chorych po wewnątrznaczyniowym leczeniu tętniaków aorty brzusznej.
Materiał i metody. 198 chorych z TAB było leczonych na drodze śródnaczyniowej. u każdego chorego 12 miesięcy po implantacji stentgraftu przeprowadzono badanie kontrolne – najpierw badanie ultrasonograficzne, a następnie badanie TK.
Wyniki. W badaniu kontrolnym po 12 miesiącach zarówno w usg, jak i TK rozpoznano: u 1 chorego zakrzepicę prawej odnogi protezy oraz u 1 chorego zakrzepicę lewej odnogi, ponadto u 2 chorych stwierdzono obecność skrzepliny w ramieniu głównym protezy. Średnia wartość maksymalnego poprzecznego wymiaru worka tętniaka oceniana w badaniu ultrasonograficznym wynosiła 53,18 ± 12,12, zaś w badaniu angio-TK – 55,12 ± 13,03. U 193 chorych przekrój poprzeczny worka tętniaka zarówno w badaniu usg, jak i TK był owalny, zaś u 5 chorych miał kształt okrągły. W badaniu usg zaciek rozpoznano u 7 chorych: u 2 podtyp I a, u 1 chorego podtyp I b, u 2 chorych podtyp II a oraz u 2 chorych II b. W badaniu angio-TK rozpoznano 15 zacieków krwi do worka tętniaka: u 2 chorych I a, u 2 chorych I b, u 6 II b i u 5 II a.
Wnioski. W badaniu usg oraz angio-TK uzyskano zgodne wyniki: w ocenie morfologii worka tętniaka, jego kształtu, maksymalnego poprzecznego wymiaru i organizacji, ocenie drożności ramion protezy i wykrywania niedrożności odnóg biodrowych. Badanie angio-TK ma wyższą czułość w porównaniu do usg w rozpoznaniu zacieku, szczególnie typu II.
Summary
Introduction. Endovascular abdominal aortic aneurysym (AAA) repair enables treatment of the patients disqualified from classical surgical repair, due to high procedural risk resulting from considerable circulatory or respiratory disorders. Currently, nearly half of the patients with AAA is treated endovascularly, approaching 70% in single sites. The method may, however, be complicated by: enlargement of the aneurysmal sac, endoleak, endograft migration, occlusion or narrowing of the main body or iliac limb extensions. In order to verify the presence and assess the frequency of possibile complications, stentraft recipients require control imaging studies.
Aim. Evaluation of the utility of various imaging modalities in the follow-up of post-EVAR patients.
Material and methods. 198 patients diagnosed with AAA were treated by means of endovascular stent graft implantation. Control imaging studies were performed in every stent graft recipient at 12 months after the procedure. Initially, ultrasound evaluation was performed, followed by CT examination.
Results. Both the control ultrasound and CT studies performed at 12 months after EVAR revealed: thrombotic occlusion of the right stent graft limb in 1 patient, and of the left stent graft limb in 1 patient as well. In addition, thrombosis of the endograft main body was detected in 2 patients. The mean value of the maximal transverse diameter of the AAA equaled 53.18 ± 12.12 for ultrasound assessment and 55.12 ± 13.03 for CT evaluation. AAA transverse cross sections had elliptical shape in 193 patients, whereas they were round in the remaining 5 patients, as assessed with both ultrasound and CT modalities. Ultrasound examination revealed the presence of endoleaks in 7 patients; 2 cases of I a, 1 case of I b, 2 cases of II a and 2 cases of II b subtype, in particular. However, 15 endoleaks were depicted by means of angio-CT: 2 cases of I a, 2 cases of I b, 6 of II b and 5 cases of II a subtype, respectively.
Conclusions. The results of ultrasound and angio-CT examinations were convergent in terms of AAA morphology and shape, the assessment of maximal transverse diameter and thrombus organization, as well as evaluating the patency and detecting occlusion of the iliac stent graft limbs. Angio-CT presented with higher sensitivity in diagnosing endoleaks, type II in particular.

Wstęp
W roku 1991 Parodi i wsp. opublikowali doniesienie o pierwszym skutecznym wyłączeniu tętniaka aorty z krążenia na drodze implantacji protezy wewnątrznaczyniowej typu stentgraft (1, 2). Wcześniej jedyną metodą leczenia tej patologii była klasyczna operacja chirurgiczna, opisana przez Oscara Creecha w 1966 roku (3). W Polsce pierwszy zabieg implantacji stentgraftu przeprowadzony został w 1998 roku w Zakładzie Radiologii Zabiegowej i Neuroradiologii Uniwersytetu Medycznego w Lublinie pod kierownictwem prof. Małgorzaty Szczerbo-Trojanowskiej. Obecnie już niemal połowa chorych z tętniakami aorty brzusznej leczona jest metodą wewnątrznaczyniową (4-6), a w pojedynczych ośrodkach odsetek ten sięga nawet 70% (7). Pozwala ona na leczenie pacjentów, którzy nie kwalifikują się do klasycznej operacji chirurgicznej z powodu wysokiego ryzyka operacyjnego będącego wynikiem zaawansowanych chorób układu krążenia i oddechowego (8). Charakteryzuje się ponadto: krótszym czasem trwania w porównaniu do metody klasycznej, skróceniem czasu hospitalizacji oraz mniejszą zachorowalnością i śmiertelnością okołooperacyjną (9-11). Wewnątrznaczyniowa metoda leczenia chorych z tętniakami aorty brzusznej obarczona jest jednak powikłaniami, takimi jak: powiększenie worka tętniaka, zaciek, migracja protezy, niedrożność lub zwężenie ramienia głównego czy odnóg biodrowych. Celem wykluczenia lub potwierdzenia powikłań i oceny częstości ich występowania chorzy po implantacji stentgraftu muszą być poddawani badaniom kontrolnym.
Do niegroźnych powikłań przeznaczyniowego leczenia tętniaków aorty brzusznej zaliczyć należy zespół poimplantacyjny występujący u mniej niż 50% chorych. Stan ten objawia się: podwyższoną temperaturą ciała, leukocytozą, wzrostem akcji serca powyżej 90/min (12-14). Obecność pęcherzyków gazu w angiografii tomografii komputerowej (angio-TK) wokół stentgraftu jest patognomoniczne dla protezy zakażonej (15). Do poważniejszych spotykanych powikłań, pomimo w pełni skutecznie przeprowadzonego zabiegu wszczepienia protezy, zaliczane są: pęknięcia, migracje, zagięcia stentgraftu, zacieki do worka tętniaka (ang. endoleak), powiększanie się worka tętniaka (ang. endotension), zakrzepice ramienia głównego lub odnóg biodrowych stentgraftu (15, 16). Pęknięcie stentgraftu to jedno z najbardziej dramatycznych powikłań leczenia przeznaczyniowego tętniaków aorty brzusznej (1). Migracja, zakrzepica, niedrożność stentgraftu obecnie są rzadko spotykanymi powikłaniami, pojawiają się u około 4% chorych w ciągu pierwszego roku obserwacji. Znaczne zmniejszenie tych powikłań spowodowane jest powszechnym dostępem do nowej generacji stentgraftów, bardziej zaawansowanych technologicznie z możliwością trwałej nadnerkowej fiksacji protezy (17). Za migrację stentgraftu przyjmuje się jego przemieszczenie względem tętnic nerkowych o ponad 10 mm. Wśród jej przyczyn należy wymienić: nietrwałą fiksację ramienia głównego protezy, zmiany patologiczne w ścianie naczynia przylegającego do stentgraftu, poszerzanie się szyi tętniaka (18). Przyczyną zakrzepicy stentgraftu jest zwykle kątowe zagięcie odnogi biodrowej protezy, a ryzyko wystąpienia tego powikłania wynosi 2,4-11,7%. Podstawowymi czynnikami ryzyka zakrzepicy są zaginanie się stentgraftu oraz znaczące zmiany miażdżycowe w odcinku biodrowym. Zwężenie ramienia głównego lub odnóg biodrowych stentgraftu spotyka się częściej w przypadku krętych tętnic biodrowych lub udowych (15). Jednym z najczęściej spotykanych powikłań jest zaciek krwi do worka tętniaka, pojawiający się w wyniku niecałkowitego wyłączenia worka tętniaka z krążenia (19, 20). Klasyfikuje się je według ich źródła i obecnie znamy pięć typów.
Wśród 5 typów autorzy rozróżniają także podtypy:
– typ I a: zaciek w okolicy bliższego mocowania stentgraftu,
– typ I b: zaciek w okolicy dalszego mocowania stentgraftu,
– typ I c: zaciek w okolicy okludera tętnicy biodrowej,
– typ II a: zaciek z tętnicy krezkowej dolnej,
– typ II b: zaciek z tętnicy lędźwiowej,
– typ III a: zaciek z powodu rozłączenia części stentgraftu,
– typ III b: zaciek z powodu rozerwania materiału pokrywającego stentgraftu,
– typ IV: zaciek spowodowany porowatością materiału pokrywającego stentgraft,
– typ V: endotension, zaciek o nieustalonym źródle pochodzenia.
Chorzy po implantacji stentgraftu wymagają wykonywania badań kontrolnych w celu wychwycenia ewentualnych powikłań.
Cel pracy
Ocena znaczenia badań obrazowych, tj. badań ultrasonograficznych (usg) i tomografii komputerowej (angio-TK), w monitorowaniu chorych po wewnątrznaczyniowym leczeniu tętniaków aorty brzusznej celem potwierdzenia lub wykluczenia powikłań.
Materiał i metody
Badania przeprowadzono u 198 chorych leczonych z powodu tętniaka aorty brzusznej metodą przeznaczyniową w Zakładzie Radiologii Zabiegowej i Neuroradiologii w Lublinie. W badanej grupie było 166 mężczyzn i 32 kobiety, w wieku od 46 do 90 lat. Wszystkim 198 chorym z tętniakiem aorty brzusznej implantowano stentgrafty w pracowni angiograficznej Zakładu Radiologii Zabiegowej i Neuroradiologii.
Każdemu choremu po leczeniu przeznaczyniowym tętniaka aorty brzusznej przeprowadzono badania kontrolne 12 miesięcy po zabiegu. Najpierw wykonywano badania ultrasonograficzne, po paru dniach badania TK jamy brzusznej z opcją angio.
Badania ultrasonograficzne przeprowadzono w Zakładzie Radiologii Zabiegowej i Neuroradiologii, natomiast badanie angio-TK w Zakładzie Radiologii i Medycyny Nuklearnej Uniwersytetu Medycznego w Lublinie.
Wszystkie badania ultrasonograficzne zostały przeprowadzone przy użyciu aparatu LOGIQ 7 (GE), wyposażonego w głowicę 3,5 MHz z możliwością obrazowania przepływu krwi przy użyciu opcji dopplerowskich (kolor, power) i nieddoplerowskich (Bflow). Procedury sonograficzne zostały przeprowadzone w pozycji leżącej chorego, na plecach, z lekko ugiętymi kończynami dolnymi w kolanach, z odsłoniętym brzuchem, bokami oraz obustronnie okolicą pachwin. U większości chorych stosowano dodatkowo ułożenie na prawym lub lewym boku. Dostęp boczny pozwala skutecznie wyeliminować ograniczenia związane z głębokością i krętym przebiegiem naczyń oraz obecnością gazów jelitowych.
Pierwszy etap badania rozpoczynano od obrazowania w prezentacji B, najpierw w poprzecznej, a następnie w podłużnej projekcji, obrazując aortę od poziomu odejścia pnia trzewnego z objęciem tętnicy krezkowej górnej i tętnic nerkowych, dokładną analizą worka tętniaka, pomiarem jego średnicy, oceną przebiegu odnóg protezy i wreszcie tętnic biodrowych do poziomu więzadła pachwinowego, a nawet tętnic udowych wspólnych. W obrębie skrzepliny, w worku wyłączonego z krążenia tętniaka szczególnie analizowano obecność obszarów bezechowych mogących świadczyć o obecności zacieku. Następny etap obejmował wykorzystanie opcji dopplerowskich (przepływu krwi kodowanego kolorem z uwzględnieniem opcji power) oraz niedopplerowskich (Bflow) w potwierdzeniu/wykluczeniu zacieku w worku tętniaka. U każdego chorego stosowano po kolei wszystkie wymienione opcje w poszukiwaniu ewentualnych patologii. Następnie przy użyciu zapisu spektralnego notowano parametry przepływu krwi w rozpoznanych zaciekach, oceniając widmo i prędkości.
Po badaniu ultrasonograficznym w odstępie kilkudniowym każdemu choremu wykonywano badanie tomografii komputerowej w Zakładzie Radiologii i Medycyny Nuklearnej Uniwersytetu Medycznej w Lublinie.
Badania zostały przeprowadzone na 64-rzędowym aparacie TK (General Electric LightSpeed Ultra). Aorta brzuszna obrazowana była od poziomu pnia trzewnego do podziału tętnic udowych w protokole szczytowego wysycenia w 30 sekund po podaniu za pomocą strzykawki automatycznej z prędkością 2,5 ml/sek. od 100 do 120 ml jodowego środka cieniującego (Ultravist 370 mg I/ml, Schering). Nominalna grubość warstwy 5 mm, 7,5 mm/sek. przesuw stołu, pitch = 1,5, 2 mm efektywna grubość warstwy.
Szczegółowa ocena stentgraftu była możliwa dzięki wykorzystaniu następujących opcji: rekonstrukcji wielopłaszczyznowych (MPR), rekonstrukcji po krzywej, projekcji minimalnej (MiP) i maksymalnej intensywności (MIP) oraz modelu trójwymiarowego (VR).
Dokonano porównań wyników w badaniach ultrasonograficznych bez podania i z podaniem ultrasonograficznego środka kontrastującego (UŚK) z wynikami angio-TK.
WYNIKI
Na podstawie badań ultrasonograficznych u wszystkich badanych chorych stwierdzono prawidłową drożność ramienia głównego stentgraftu w każdej w wykonanych opcji, tj. przepływu krwi kodowanego kolorem, z uwzględnieniem Dopplera mocy oraz obrazowania Bflow. Przeprowadzone badanie usg u 1 chorego ujawniło zakrzepicę prawej odnogi protezy oraz u 1 chorego zakrzepniętą lewą odnogę stentgraftu (tab. 1, 2, ryc. 1).
Tab. 1. Ocena drożności prawej odnogi stentgraftu w badaniu ultrasonograficznym
| Kategoria | Drożność prawej odnogi stentgraftu |
| N | % |
| tak | 197 | 99,49495 |
| nie | 1 | 0,50505 |
N – liczba badanych
Tab. 2. Ocena drożności lewej odnogi stentgraftu w badaniu ultrasonograficznym
| Kategoria | Drożność lewej odnogi stentgraftu |
| N | % |
| tak | 197 | 99,49495 |
| nie | 1 | 0,50505 |
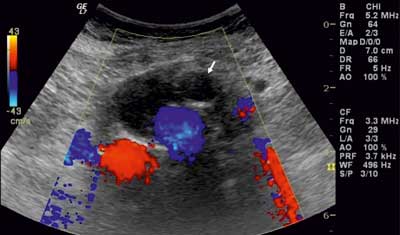
Ryc. 1. Zakrzepica jednej z odnóg stentgraftu (strzałka) w badaniu dopplerowskim z użyciem opcji przepływu krwi kodowanego kolorem – przekrój poprzeczny
U pozostałych badanych stwierdzono prawidłową drożność odnóg protezy we wszystkich trzech wykonanych opcjach. U 2 chorych w obrazowaniu w prezentacji B oraz w opcjach przepływu krwi kodowanego kolorem, z uwzględnieniem Dopplera mocy oraz obrazowania Bflow stwierdzono obecność skrzepliny w obrębie głównego ramienia stentgraftu (tab. 3, ryc. 2). U jednego chorego opisywana skrzeplina przechodziła na prawą odnogę protezy i powodowała całkowitą zakrzepicę. U pozostałych 196 badanych nie ujawniono obecności skrzeplin. Średnia wartość maksymalnego poprzecznego wymiaru worka tętniaka oceniana w badaniu ultrasonograficznym wynosiła 53,18 ± 12,12 (ryc. 3).
Tab. 3. Obecność skrzepliny w ramieniu głównym stentgraftu w badaniu ultrasonograficznym
| Kategoria | Skrzeplina w ramieniu głównym stentgraftu |
| N | % |
| nie | 196 | 98,98990 |
| tak | 2 | 1,01010 |
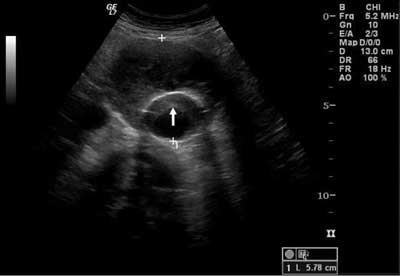
Ryc. 2. Skrzeplina w ramieniu głównym stentgraftu, przy ścianie przedniej (strzałka) w badaniu w prezentacji B – przekrój poprzeczny
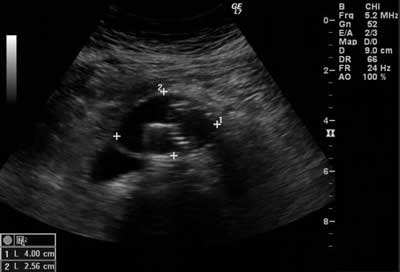
Ryc. 3. Pomiar średnicy worka tętniaka w prezentacji B – przekrój poprzeczny
U 193 chorych przekrój poprzeczny worka tętniaka był owalny, zaś u 5 chorych miał kształt okrągły (tab. 4).
Tab. 4. Ocena kształtu worka tętniaka w badaniu ultrasonograficznym
| Kategoria | Kształt worka tętniaka |
| N | % |
| okrągły | 5 | 2,52525 |
| owalny | 193 | 97,47475 |
U 86 chorych w worku tętniaka, szczególnie na obwodzie, stwierdzono obecność dość licznych zwapnień (tab. 5).
Tab. 5. Obecność zwapnień w worku tętniaka w badaniu ultrasonograficznym
| Kategoria | Zwapnienia w worku tętniaka |
| N | % |
| nie | 112 | 56,56566 |
| tak | 86 | 43,43434 |
U 120 chorych (60,6%) worek tętniaka zawierał organizujące się skrzepliny. W tej grupie u 1 chorego w worku tętniaka rozpoznano obecność bezechowych stref, dodatkowo o 7 mm wzrost średnicy worka tętniaka.
U 78 chorych (39,4%) worek tętniaka był całkowicie zorganizowany.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Laborde JC, Parodi JC, Clem MF et al.: Intraluminal bypass of abdominal aortic aneurysm: feasibility study. Radiology 1992 Jul; 184(1): 185-190.
2. Parodi JC, Palmaz JC, Barone HD: Transfemoral intraluminal graft implantation for abdominal aortic aneurysms. Ann Vasc Surg 1991 Nov; 5(6): 491-499.
3. Creech O Jr: Endo-aneurysmorrhaphy and treatment of aortic aneurysm. Ann Surg 1966 Dec; 164(6): 935-946.
4. Shah H, Kumar SR, Major K et al.: Technology penetration of endovascular aortic aneurysm repair in southern California. Ann Vasc Surg 2006 Nov; 20(6): 796-802.
5. Berge C, Haug ES, Romundstad PR et al.: Infrarenal abdominal aortic aneurysm repair: time-trends during a 20-year period. World J Surg 2007 Aug; 31(8): 1682-1686. Epub 2007 Jun 15.
6. Hill JS, McPhee JT, Messina LM et al.: Regionalization of abdominal aortic aneurysm repair: evidence of a shift to high-volume centers in the endovascular era. J Vasc Surg 2008 Jul; 48(1): 29-36.
7. Schanzer A, Greenberg RK, Hevelone N et al.: Predictors of abdominal aortic aneurysm sac enlargement after endovascular repair. Circulation 2011 Jun 21; 123(24): 2848-2855.
8. Cao P, Verzini F, Parlani G et al.: Clinical effect of abdominal aortic aneurysm endografting: 7-year concurrent comparison with open repair. J Vasc Surg 2004 Nov; 40(5): 841-848.
9. Bush RL, Johnson ML, Collins TC et al.: Open versus endovascular abdominal aortic aneurysm repair in VA hospitals. J Am Coll Surg 2006 Apr; 202(4): 577-587.
10. Matsumura JS, Brewster DC, Makaroun MS, Naftel DC: A multicenter controlled clinical trial of open versus endovascular treatment of abdominal aortic aneurysm. J Vasc Surg 2003 Feb; 37(2): 262-271.
11. Carpenter JP: Midterm results of the multicenter trial of the powerlink bifurcated system for endovascular aortic aneurysm repair. J Vasc Surg 2004 Nov; 40(5): 849-859.
12. Upchurch GR, Schaub TA: Abdominal aortic aneurysm. Am Fam Physician 2006; 73: 1198-1204.
13. Waliszewski K, Słomski R, Oszkinis G, Majewski W: Genetyczne aspekty powstawania tętniaków aorty brzusznej. Pol Merk Lek 2005; 18(103): 111-114.
14. Yeung BKF, Pearce WH: Surgical management of abdominal aortic aneurysm. Vasc Med 2000; 5: 187-193.
15. Volodos NL, Karpovich IP, Troyan VI et al.: Clinical experience of the use of self-fixing synthetic prostheses for remote endoprosthetics of the thoracic and the abdominal aorta and iliac arteries through the femoral artery and as intraoperative endoprosthesis for aorta reconstruction. Vasa Suppl 1991; 33: 93-95.
16. Gloviczki P, Pairolero P, Welch T et al.: Multiple aortic aneurysms: the results of surgical management. J Vasc Surg 1990 Jan; 11(1): 19-27; discussion 27-28.
17. Ward AS: Aortic aneurysmal disease. A generalized dilating diathesis. Arch Surg 1992 Aug; 127(8): 990-991.
18. Kunecki M, Danilewicz M, Nawrocka-Kunecka A: Usefulness of serum VEGF concentration measurement to estimate aortic aneurysm risk of rupture. Acta Angiol 2006; 12(1): 7-15.
19. Wiercnicki I, Millo B, Ciechanowski K et al.: Patogeneza tętniaka aorty brzusznej a polimorfizm haptoglobiny i czynnik zapalny. Wiad Lek 1999; 52(11-12): 581-586.
20. Ogata T, Shibamura H, Tromp G et al.: Genetic analysis of polymorphisms relevant candidate genes in patients with abdominal aortic aneurysms. J Vasc Surg 2005; 41(6): 1036-1042.
21. Lederle FA, Johnson GR, Wilson SE et al., Veterans Affairs Cooperative Study #417 Investigators: Rupture rate of large abdominal aortic aneurysms in patients refusing or unfit for elective repair. JAMA 2002 Jun 12; 287(22): 2968-2972.
22. Szmidt J: Tętniaki aorty brzusznej. [W:] Szmidt J (red.): Podstawy chirurgii. Tom I. Medycyna Praktyczna, Kraków 2003: 951.
23. Farner MC, Carpenter JP, Baum RA, Fairman RM: Early changes in abdominal aortic aneurysm diameter after endovascular repair. J Vasc Interv Radiol 2003; 14: 205-210.
24. Dorffner R, Thurnher S, Polterauer P et al.: Treatment of abdominal aoric aneurysms with transfemoral placement of stent-garfts: Complicatons and secondary radiologic intervention. Radiology 1997; 204: 79-86.
25. Dorffner R: Helical CT after aortic stent-graft implantation. AJR Am J Roentgenol 1999; 172(6): 1690-1691.
26. Arko FR, Filis KA, Heikkinen MA et al.: Duplex scanning after endovascular aneurysm repair: an alternative to computed tomography. Semin Vasc Surg 2004 Jun; 17(2): 161-165.
27. Raman KG, Missig-Carroll N, Richardson T et al.: Color-flow duplex ultrasound scan versus computed tomographic scan in the surveillance of endovascular aneurysm repair. J Vasc Surg 2003 Oct; 38(4): 645-651.
28. Henao EA, Hodge MD, Felkai DD et al.: Contrast-enhanced Duplex surveillance after endovascular abdominal aortic aneurysm repair: improved efficacy using a continuous infusion technique. J Vasc Surg 2006 Feb; 43(2): 259-264; discussion 264.
29. Heikkinen MA, Arko FR, Zarins CK: What is the significance of endoleaks and endotension. Surg Clin North Am 2004 Oct; 84(5): 1337-1352.
30. Ouriel K, Clair DG, Greenberg RK et al.: Endovascular repair of abdominal aortic aneurysms: device-specific outcome. J Vasc Surg 2003 May; 37(5): 991-998.
31. AbuRahma AF: Fate of endoleaks detected by CT angiography and missed by color duplex ultrasound in endovascular grafts for abdominal aortic aneurysms. J Endovasc Ther 2006 Aug; 13(4): 490-495.
32. White GH, Yu W, May J, Chaufour X, Stephen MS: Endoleak as a complication of endoluminal grafting of abdominal aortic aneurysms: classification, incidence, diagnosis, and management. J Endovasc Surg 1997 May;4(2):152-168.
33. Soulen MC, Fairman RM, Baum RA: Embolization of the internal iliac artery: still more to learn. J Vasc Interv Radiol 2000; 11: 543-545.
34. Baum RA, Carpenter JP, Stavropoulous SW, Fairman RM: Diagnosis and management of type 2 endoleaks after endovascular aneurysm repair. Tech Vasc Interv Radiol 2001; 4(4): 222-226.
35. Heilberger P, Schunn Ch, Ritter W et al.: Postoperative color flow duplex scanning in aortic endografting. J Endovasc Surg 1997; 4: 262-271.
36. AbuRahma AF, Welch CA, Mullins BB, Dyer B: Computed tomography versus color duplex ultrasound for surveillance of abdominal aortic stent-grafts. J Endovasc Ther 2005; 12(5): 568-573.
37. Sato DT, Goff CD, Gregory RT et al.: Endoleak after aortic stent graft repair: diagnosis by color duplex ultrasound scan versus computed tomography scan. J Vasc Surg 1998; 28: 657-663.
38. Wolf YG, Johnson BL, Hill BB et al.: Duplex ultrasound scanning versus computed tomographic angiography for postoperative evaluation of endovascular abdominal aortic aneurysm repair. J Vascular Surgery 2000; 32(6): 1142-1148.



