Zofia Dzierżewicz1, Radosław Balwierz1, Dominik Marciniak2, Beata Sarecka-Hujar3, Marcin Delijewski4, Barbara Dolińska3
Plejotropowe działanie melatoniny
Pleiotropic effect of melatonin
1Wydział Ochrony Zdrowia, Śląska Wyższa Szkoła Medyczna w Katowicach
2Katedra i Zakład Farmacji Stosowanej, Uniwersytet Medyczny im. Piastów Śląskich we Wrocławiu
3Katedra i Zakład Technologii Postaci Leku, Śląski Uniwersytet Medyczny w Katowicach
4Katedra i Zakład Farmakologii, Wydział Lekarski z Oddziałem Lekarsko-Dentystycznym w Zabrzu, Śląski Uniwersytet Medyczny w Katowicach
Summary
Melatonin is a hormone synthesized mainly by the pineal gland. Its precursor is the exogenous amino acid L-tryptophan. The basic function of this hormone is the regulation of circadian and seasonal rhythms. As an amphiphilic molecule, melatonin can easily cross biological barriers, which is why its effects can be exerted through a variety of mechanisms. Both in experimental and clinical studies, the cardioprotective effect of melatonin has been demonstrated. Melatonin also plays a role in the regulation of the immune response. In addition, it is particularly effective in inactivating hydroxyl radicals, including the most reactive oxygen radical. Melatonin can inhibit the division of tumor cells by affecting the release of other hormones and substances involved in the process of carcinogenesis. It also limits the process of nerve cell death and adverse changes in the nervous system associated with the etiopathogenesis of Alzheimer’s disease. Melatonin is on the list of OTC preparations (over the counter), medicines available at the pharmacy without a prescription. This paper presents the biosynthesis of melatonin and its metabolism and discusses its physiological and clinical significance in the human body.

Wstęp
Melatoninę z szyszynek bydlęcych wyizolował Aaron Lerner ponad 60 lat temu. Wówczas uważano, że jej zadaniem jest regulacja dobowego cyklu snu i czuwania oraz rytmu pór roku. Stwierdzono bowiem, że wysokie stężenia melatoniny utrzymują się przez dłuższy czas w okresie zimowym, a latem zdecydowanie krócej. U ludzi zegar biologiczny regulowany jest dostępem światła i zaczyna działać już około 20. tygodnia życia, ale z wiekiem jego funkcjonowanie ulega pogorszeniu. Przyczyną tego są zmiany w obrębie szyszynki, która z upływem czasu ulega kalcyfikacji i ma mniejszą zdolność syntezy tego hormonu. Badania nad funkcją melatoniny wykazały, że jej znaczenie dla organizmu nie ogranicza się wyłącznie do roli zegara biologicznego, ale dotyczy również innych ważnych funkcji fizjologicznych, w tym hormonalnych.
Pod koniec ubiegłego stulecia po raz pierwszy zaproponowano korelację między niedostateczną syntezą melatoniny a wystąpieniem zwiększonego ryzyka zachorowania na raka piersi. Obniżony poziom melatoniny może bowiem mieć związek z podwyższeniem poziomu estrogenów, co wpływa na procesy nowotworzenia w gruczole piersiowym (1). W badaniach na grupie kobiet przyjmujących hormonalną terapię zastępczą potwierdzono, że podwyższony poziom estrogenów obniża poziom melatoniny, nie wpływając jednak na rytm okołodobowego jej wydzielania (2). Dowiedziono także, że właściwości fizykochemiczne melatoniny sprawiają, że może ona spełniać ochronną rolę wobec białek, lipidów oraz kwasów nukleinowych, będąc efektywnym donorem elektronów w procesie neutralizacji reaktywnych form tlenu i azotu (ang. reactive oxygen species – RFT, ang. reactive nitrogen species – RFA) (3, 4). Uważa się, że melatonina może hamować proces obumierania komórek nerwowych i spowalniać niektóre zmiany w układzie nerwowym związane z etiologią choroby Alzheimera. Ponadto, melatonina ogranicza proces nowotworzenia. Z jednej strony hamuje podziały komórek nowotworowych i wpływ na uwalnianie innych hormonów i substancji zaangażowanych w tym procesie, a z drugiej strony wywiera działanie pobudzające na układ odpornościowy. W badaniach eksperymentalnych wykazano korzystny wpływ melatoniny na przebieg procesów przeciwdziałających starzeniu się (5), co może przyczyniać się do zapobiegania chorobom związanym z wiekiem lub do ich łagodnego przebiegu.
Z uwagi zatem na wszechstronne możliwe właściwości melatoniny celem pracy było omówienie jej biosyntezy, metabolizmu i roli w procesach fizjologicznych oraz przegląd i omówienie dostępnych danych literaturowych dotyczących znaczenia klinicznego tego hormonu w organizmie człowieka.
Biosynteza i losy melatoniny w ustroju
Melatonina to hormon produkowany w ludzkim organizmie przez szyszynkę. W pinealocytach, głównych komórkach budujących gruczoł szyszynki, przebiega synteza tego hormonu. Melatonina nie jest w szyszynce magazynowana, lecz dyfunduje do naczyń włosowatych i płynu mózgowo-rdzeniowego, a stąd z krwią dociera na obwód, gdzie ma możliwość oddziaływania na różne tkanki i narządy. Stężenie melatoniny niezależnie od aktywności dobowej jest zawsze najwyższe w nocy, osiągając maksymalną wartość między godzinami 24.00 a 3.00 rano, po czym łagodnie spada, uzyskując przed świtem niskie wartości podobne do tych stwierdzanych w ciągu dnia. Zatem podstawowym regulatorem wydzielania melatoniny jest cykl światło-ciemność (6-11).
Melatonina po przedostaniu się do krwiobiegu, w związku z jej słabą rozpuszczalnością w wodzie, wiąże się głównie z albuminami, ale stwierdza się także jej kompleksy z kwaśną glikoproteiną osocza. Wysoka lipofilność melatoniny sprzyja jej transportowi przez różne struktury błoniaste, co w konsekwencji przejawia się jej zdolnością do wielokierunkowego działania (7, 10-12).
Substratem do biosyntezy melatoniny jest pochodzący z pokarmu aromatyczny aminokwas tryptofan, pobierany wbrew gradientowi stężeń z krwi przez pinealocyty i w dwóch kolejnych reakcjach (hydroksylacji i dekarboksylacji) zostaje przekształcony w serotoninę (5-hydroksytryptamina – 5-HT). Z serotoniny powstaje melatonina w wyniku kolejnego działania dwóch enzymów klasy transferaz: arylo-alkilo-amino-N-acetylotransferazy serotoninowej (AA-NAT) oraz transferazy hydroksyindolo-O-metylowej (HIOMT) (ryc. 1). Regulacja syntezy tego hormonu jest złożonym mechanizmem, obejmującym aktywację transferazy AA-NAT przez fosforylację zależną od cAMP oraz jej stabilizację przez białko 14-3-3, które jest konserwatywną proteiną obecną w cytoplazmie neuronów i pełni rolę w transdukcji sygnału, kontroli cyklu komórkowego i apoptozie. Synteza melatoniny podlega także regulacji zwrotnej, która zachodzi pod wpływem zależnego od cAMP indukowanego wczesnego represora molekuły 3’,5’-cAMP oraz przez zależne od jonów wapnia powstawanie antagonistycznego modulatora (6, 7). Sekwencja procesów przebiega następująco:
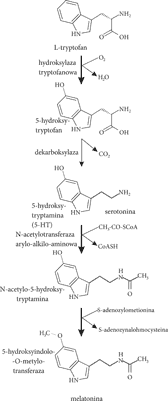
Ryc. 1. Synteza melatoniny
ciemność → ↑cAMP → ↑AA-NAT → ↑melatonina w szyszynce → ↑melatonina w krwi.
Wydzielona do krwi melatonina jest metabolizowana głównie w wątrobie i częściowo w nerkach. W pierwszej kolejności podlega reakcji I fazy w pozycji C6, gdzie zachodzi hydroksylacja przy udziale monooksygenazy cytochromowej – P450 (Cyp-450). Następnie dochodzi do procesu sprzęgania (II faza metabolizmu) z udziałem endogennych związków: z aktywnym siarczanem (PAPS-adenozyno-3’-fosfo-5’-fosfosiarczan) i/lub kwasem glukuronowym. Ulega także demetylacji, przechodząc w jej prekursorową cząsteczkę N-acetyloserotoninę. Śladowe ilości melatoniny usuwane są z moczem w postaci niezmienionej. Istnieją doniesienia, że melatonina może być także nieenzymatycznie modyfikowana zarówno w komórkach, jak i pozakomórkowo przy udziale wolnych rodników i innych utleniaczy (13, 14).
Poza syntezą przebiegającą w pinealocytach melatonina powstaje także poza szyszynką. Synteza ta może mieć charakter konstytutywny lub indukowany i nie przyczynia się do kształtowania mierzonego w krwi rytmu dobowego. W układzie pokarmowym melatonina występuje w stosunkowo dużych ilościach, począwszy od żołądka do jelita grubego, gdzie wpływa na sterowanie ruchami jelit. Część hormonu ulega wchłonięciu ze światła jelit do krwiobiegu, co może tłumaczyć zjawisko senności po obfitym posiłku. Melatoninę wytwarza również siatkówka oka, komórki skóry, układu odpornościowego, w tym limfocyty, komórki tuczne czy płytki krwi (6, 8, 15-18).
Wpływ melatoniny na czynność układu naczyniowo-sercowego
Jednym z elementów rytmów dobowych ludzkiego organizmu jest dobowy rytm ciśnienia tętniczego. Najniższe wartości ciśnienia odnotowywane są podczas snu, gdy stężenie melatoniny jest najwyższe. Oprócz fizjologicznego spadku ciśnienia tętniczego krwi dochodzi także do zwolnienia akcji serca, której towarzyszy wzrost jego pojemności minutowej i aktywności pompy wapniowej. W kilku prospektywnych badaniach obserwacyjnych stwierdzono zwiększone ryzyko zapadalności na choroby sercowo-naczyniowe u osób, u których nie stwierdza się nocnego spadku ciśnienia w porównaniu z pacjentami z grupy chrakteryzującej się spadkiem ciśnienia podczas snu (10, 19, 20). Zjawisko porannego wzrostu ciśnienia tętniczego wiąże się z prawidłowym dobowym profilem ciśnienia. Zwiększona częstość epizodów sercowo-naczyniowych, jak udary mózgowe czy zawały serca, ma miejsce właśnie we wczesnych godzinach porannych. Jednak uważa się, że ten poranny wzrost ciśnienia jako jednostkowy czynnik nie odpowiada za skutki kardiologiczne, lecz towarzyszą mu jeszcze dodatkowe zjawiska, np. skłonność do skurczu tętnic wieńcowych czy większa skłonność prozakrzepowa (20-23).
U niektórych pacjentów obserwuje się nie tylko brak fizjologicznego spadku ciśnienia, ale nawet jego nocny wzrost. Brak nocnego spadku ciśnienia tętniczego zaobserwowano u istotnego odsetka chorych na pierwotne nadciśnienie tętnicze oraz u pacjentów z postaciami wtórnego nadciśnienia, z cukrzycą, obturacyjnym bezdechem, niewydolnością serca i po jego transplantacji. W tych przypadkach najczęściej również spada stężenie zarówno melatoniny, jak i wydalonego z moczem siarczanu 6-hydroksymelatoniny. Stąd też od kilkunastu lat rośnie zainteresowanie współistnieniem zaburzeń układu krążenia ze zmianą stężeń melatoniny. U pacjentów z objawami klinicznymi choroby niedokrwiennej serca o umiarkowanym nasileniu, a także podczas ostrego incydentu zawałowego wykazano spadek nocnego szczytu wydzielania melatoniny (19, 21). Z kolei u pacjentów z niestabilną dusznicą bolesną wydalanie metabolitu siarczanu 6-hydroksymelatoniny z moczem było mniejsze w porównaniu z ludźmi zdrowymi oraz pacjentami z ustabilizowaną dusznicą. Wykazano ponadto, iż poziom powyższego metabolitu jest odwrotnie proporcjonalny do wieku zdrowych ludzi (20-22).
U niektórych chorych z nadciśnieniem tętniczym dochodzi do zaburzenia fizjologicznego rytmu wydzielania melatoniny. Zakłócenie rytmu wytwarzania melatoniny może mieć charakter pierwotny lub wtórny wobec współistniejących u tych chorych zaburzeń hormonalnych. Obserwowany jest również hipotensyjny efekt egzogennego podawania melatoniny (19, 22-25).
Postulowanych jest kilka mechanizmów oddziaływania melatoniny na ciśnienie tętnicze: ośrodkowe zmniejszenie aktywności współczulnej przez wpływ na receptory melatoninowe obecne w jądrze nadskrzyżowaniowym, bezpośredni efekt naczyniorozszerzający (efekt receptorowy), poprawienie funkcji śródbłonka czy też działanie antyoksydacyjne hormonu. Zdania co do współzależności udziału melatoniny w aktywności układu adrenergicznego są podzielone. Trwa spór na temat roli melatoniny w aktywności układu współczulnego. Część badaczy uważa, że melatonina zmniejsza jego aktywność, natomiast inni są za wykluczeniem jej udziału w aktywności układu współczulnego. Należy wspomnieć, że niektóre leki hipotensyjne mogą zaburzyć dobowy profil wydzielania melatoniny lub też melatonina może zaburzać ich efekt działania. Znany jest efekt zahamowania wydzielania melatoniny podczas terapii β-adrenolitykami. Niskie nocne stężenie hormonu może być odpowiedzialne za zaburzenie snu, co sygnalizują pacjenci stosujący tę grupę leków (10, 23, 24).
Rola melatoniny w układzie immunologicznym
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Cohen M, Lippman M, Chabner B: Role of pineal gland in aetiology and treatment of breast cancer. Lancet 1978; 2(8094): 814-816.
2. Kos-Kudla B, Ostrowska Z, Marek B et al.: Circadian rhythm of melatonin in postmenopausal asthmatic women with hormone replacement therapy. Neuro Endocrinol Lett 2002; 23(3): 243-248.
3. Bandyopadhyay D, Biswas K, Bandyopadhyay U et al.: Melatonin protects against stress-induced gastric lesions by scavenging the hydroxyl radical. J Pineal Res 2000; 29(3): 143-151.
4. Poeggeler B, Reiter RJ, Tan DX et al.: Melatonin, hydroxyl radical-mediated oxidative damage, and aging: a hypothesis. J Pineal Res 1993; 14(4): 151-168.
5. Tajes M, Gutierrez-Cuesta J, Ortuño-Sahagun D et al.: Anti-aging properties of melatonin in an in vitro murine senescence model: involvement of the sirtuin 1 pathway. J Pineal Res 2009; 47(3): 228-237.
6. Skwarło-Sońta K, Majewski P: Melatonina, wielofunkcyjna cząsteczka sygnałowa w organizmie ssaka: miejsce biosyntezy, funkcje, mechanizm działania. Folia Medica Lodziensia 2010; 37(1): 15-55.
7. Danielczyk K, Dzięgiel P: Receptory melaninowe MT1 oraz ich rola w onkostatycznym działaniu melatoniny. Postepy Hig Med Dosw 2009; 63: 425-434.
8. Mańka S, Majewska E: Immunoregulacyjne działanie melatoniny. Mechanizm działania i wpływ na komórki procesu zapalnego. Postepy Hig Med Dosw 2016; 70: 1059-1067.
9. Bukowska A: Rola melatoniny w procesach antynowotworowych – potencjalne mechanizmy. Medycyna Pracy 2011; 62(4): 425-434.
10. Kazimierczak A, Lewandowski J, Łapiński M: Czy melatonina bierze udział w regulacji dobowego rytmu ciśnienia tętniczego krwi. Arterial Hypertension 2006; 10(1): 69-77.
11. Nowak JZ, Zawilska JB: Melatonina i jej rola w funkcji systemu okołodobowego. Postepy Hig Med Dosw 1999; 53: 445-471.
12. van Marke de Lumen K, Kędziora-Kornatowska K, Czuczejko J et al.: Wpływ melatoniny na wybrane parametry stresu oksydacyjnego u osób w podeszłym wieku z pierwotnym nadciśnieniem tętniczym (badania wstępne). Gastroenterol Pol 2005; 13(3): 206-210.
13. Juszczak M, Michalska M: Rola szyszynki oraz melatoniny w regulacji syntezy i wydzielania wybranych hormonów części gruczołowej przysadki. Postepy Hig Med Dosw 2006; 60: 653-659.
14. Gustaw K: Melatonina, nietypowy antyoksydant. Rola w patologii choroby Alzheimera. Propozycja terapii. Farmakoter Psychiatr Neurol 2003; 4: 59-69.
15. Popławski PT, Derlacz RA: Jak działa melatonina? Postępy Biochemii 2003; 49(1): 9-17.
16. Reiter RJ, Tan D-X, Manchester LC et al.: Przewód pokarmowy i melatonina: hamowanie zjawisk patofizjologicznych. Geront Pol 2010; 17(3): 213-218.
17. Iżykowska I, Piotrowska A, Podhorska-Okołów M et al.: Ochronna rola melatoniny podczas działania promieniowania UV. Postepy Hig Med Dosw 2008; 62: 23-27.
18. Słominski A, Fischer TW, Zmijewski MA et al.: On the role of melatonin in skin physiology and pathology. Endocrine 2005; 27: 137-148.
19. Kazimierczak A, Lewandowski J, Artyszuk Ł et al.: Wpływ melatoniny na profil dobowy ciśnienia u chorych z brakiem nocnego obniżenia ciśnienia tętniczego. Arterial Hypertension 2014; 18(3): 134-142.
20. Sewerynek E: Melatonin and the cardiovascular system. Neuroendocrinol Lett 2002; 23: 79-83.
21. Jonas M, Garfinkel D, Zisapel N et al.: Impaired nocturnal melatonin secretion in non-dipper hypertensive patients. Blood Pressure 2003; 12: 19-24.
22. Dominquez-Rodriguez A, Abreu-Gonzalez P, Garcia MJ et al.: Decreased nocturnal melatonin levels during acute myocardial infarction. J Pineal Res 2002; 33: 248-252.
23. Fagard RH, Thijs L, Staessen JA: Night-day blood pressure ratio and dipping pattern as prediction of death an d cardiovascular events in hypertension. J Hum Hypertens 2009; 23: 645-653.
24. Sewerynek E: Wpływ melatoniny na czynność układu sercowo-naczyniowego. Folia Medica Lodziensia 2010; 37(1): 69-87.
25. Stoschitzky KL, Sakotnik A, Lercher P et al.: Influence of beta-blockers on melatonin release. Eur J Clin Pharmacol 1999; 55: 111-115.
26. Carrillo-Vico A, Guerrero JM, Lardone PJ, Reiter RJ: A revive of the multiple action of melatonin on the immune system. Endocrine 2005; 27: 189-200.
27. Carrillo-Vico A, Lardone PJ, Alnarez-Sanchez N et al.: Melatonin: buffering the immune system. Int J Mol Sci 2013; 14: 8638-8683.
28. Karasek M: Znaczenie kliniczne melatoniny. Post Nauk Med 2007; 10(1): 395-398.
29. Guerrero JM, Reiter RJ: Melatonin-immune system relationships. Curr Top Med Chem 2002(2): 167-179.
30. Reiter RJ: Melatonin: clinical relevance. Best Pract Res Clin Endocrinol Metab 2003; 17: 273-285.
31. Sroka Z, Gamian A, Cisowski W: Niskocząsteczkowe związki przeciwutleniające pochodzenia naturalnego. Postepy Hig Med Dosw 2005; 59: 34-41.
32. Grabińska K, Wróbel M, Mykała-Cieśla J, Wichary H: Przegląd doniesień na temat wpływu melatoniny na patogenezę i terapię raka piersi. Ann Acad Med Siles 2010; 64(3-4): 58-69.
33. Stevens RG: Electric power use and breast cancer: a hypothesis. Am J Epidemiol 1987; 125(4): 556-561.
34. Stevens RG: Light-at-night, circadian disruption and breast cancer: assessment of existing evidence. Int J Epidemiol 2009; 378(4): 963-970.
35. Stryjewski PJ, Domal-Kwiatkowska D, Mazur U, Nowalny-Kozielska E: Wpływ pracy nocnej i zmianowej na zdrowie pracowników. Prz Lek 2016; 73(7): 513-515.
36. Bilski B, Perz S, Perz K: Czy melatonina może być skuteczna w profilaktyce i leczeniu zaburzeń związanych z pracą zmianową i nocną? Med Pr 2005; 56(3): 257-261.
37. Jabłońska K, Zemła A, Dzięgiel P: Rola melatoniny w nowotworach gruczołu piersiowego, jajnika oraz endometrium. Post Biol Komórki 2011; 38(1): 177-194.
38. Li Y, Li S, Zhou Y et al.: Melatonin for the prevention and treatment of cancer. Oncotarget 2017; 8(24): 39896-39921.
39. Nooshinfar E, Safaroghli-Azar A, Bashash D, Akbari ME: Melatonin, an inhibitory agent in breast cancer. Breast Cancer 2017; 24(1): 42-51.
40. Dillon DC, Easley SE, Asch BB et al.: Differential expression of High-affinity melatonin receptor MT1 in normal and malignant human breast tissue. Am J Clin Pathol 2002; 118(3): 451-458.
41. Lenoir V, de Jonage-Canonico MB, Perrin MH et al.: Preventive and curative effect of melatonin on mammary carcinogenesis induced by dimethylbenz(a)anthracene in the female Sprague-Dawley rat. Breast Cancer Res 2005; 7(4): R470-R4763.
42. Shrestha S, Zhu J, Wang Q et al.: Melatonin potentiates the antitumor effect of curcumin by inhibiting IKKβ/NF-κB/COX-2 signaling pathway. Int J Oncol 2017. DOI: 10.3892/ijo.2017.4097.
43. Zemła A, Grzegorek I, Dzięgiel P, Jabłońska K: Melatonin Synergizes the Chemotherapeutic Effect of Cisplatin in Ovarian Cancer Cells Independently of MT1 Melatonin Receptors. In Vivo 2017; 31(5): 801-809.
44. Pariente R, Bejarano I, Rodríguez AB et al.: Melatonin increases the effect of 5-fluorouracil-based chemotherapy in human colorectal adenocarcinoma cells in vitro. Mol Cell Biochem 2017. DOI: 10.1007/s11010-017-3154-2.
45. Blask DE, Sauer LA, Dauchy RT: Melatonin as a chronobiotic/anticancer agent: cellular, biochemical, and molecular mechanisms of action and their implication for circadian-based cancer therapy. Curr Top Med Chem 2002; 2: 113-132.
46. Galley HF, McCormick B, Wilson KL et al.: Melatonin limits paclitaxel-induced mitochondrial dysfunction in vitro and protects against paclitaxel-induced neuropathic pain in the rat. J Pineal Res 2017. DOI: 10.1111/jpi.12444.
47. Karasek M: Melatonin in human physiology and pathology. [In:] Columbus F (ed.): Frontiers in chronobiology. Nova Science, New York 2006: 1-43.
48. Wetterberg L: Melatonin and clinical application. Reprod Nutr Develop 1999; 39: 367-382.
49. Swanson GR, Gorenz A, Shaikh M et al.: Decreased melatonin secretion is associated with increased intestinal permeability and marker of endotoxemia in alcoholics. Am J Physiol Gastrointest Liver Physiol 2015; 308(12): G1004-G1011.
50. Reiter RJ, Cabrera J, Sainz RM et al.: Melatonin as pharmacological agent against neuronal loss in experimental models of Huntington’s disease, Alzheimer’s disease and parkinsonism. Ann NY Acad Sci 1999; 890: 471-485.
51. Gustaw K: Melatonina, nietypowy antyoksydant. Rola w patologii choroby Alzheimera. Propozycja terapii. Farmakoter Psychiatr Neurol 2003; 4: 59-69.
52. Sirin FB, Kumbul Doğuç D, Vural H et al.: Plasma 8-isoPGF2α and serum melatonin levels in patients with minimal cognitive impairment and Alzheimer disease. Turk J Med Sci 2015; 45(5): 1073-1077.
53. Więdłocha M, Stańczykiewicz B, Jakubik M, Rymaszewska J: Wybrane mysie modele oparte na mutacji genów APP, MAPT oraz presenilin wykorzystywane w badaniach nad patogenezą choroby Alzheimera. Postepy Hig Med Dosw 2012; 66: 415-430.
54. Nie L, Wei G, Peng S et al.: Melatonin ameliorates anxiety and depression-like behaviors and modulates proteomic changes in triple transgenic mice of Alzheimer’s disease. Biofactors 2017; 43(4): 593-611.
55. Wade AG, Farmer M, Harari G et al.: Add-on prolonged-release melatonin for cognitive function and sleep in mild to moderate Alzheimer’s disease: a 6-month, randomized, placebo-controlled, multicenter trial. Clin Interv Aging 2014; 9: 947-961.
56. Wang YY, Zheng W, Ng CH et al.: Meta-analysis of randomized, double-blind, placebo-controlled trials of melatonin in Alzheimer’s disease. Int J Geriatr Psychiatry 2017; 32(1): 50-57.

