© Borgis - Postępy Nauk Medycznych 10/2009, s. 751-756
Włodzimierz Januszewicz, *Andrzej Januszewicz
Aldosteron – hormon o wielu obliczach**
Aldosteron – hormon with multiple faces
Klinika Nadciśnienia Tętniczego, Instytut Kardiologii w Warszawie
Kierownik Kliniki: prof. dr hab. med. Andrzej Januszewicz
Streszczenie
W okresie ostatnich ponad 50 lat dokonał się dynamiczny rozwój wiedzy, który umożliwił poznanie nowych właściwości biologicznych aldosteronu. Wykazano, że oprócz istotnej roli w regulacji gospodarki wodno-elektrolitowej, aldosteron może wywierać bezpośredni uszkadzający wpływ na układ sercowo-naczyniowy niezależny od angiotensyny II. W ostatnich latach poznano również inne pozanadnerczowe miejsca biosyntezy aldosteronu oraz różnorodną lokalizację receptorów dla aldosteronu. Odkrycia te doprowadziły do szerokiego zastosowania blokerów receptorów mineralokortykoidowych w różnych stanach chorobowych układu sercowo-naczyniowego.
Summary
During the last 50 years a new biological properties of aldosterone were recognized. It was also found that besides important role in the water electrolyte metabolism aldosterone may directty influence cardiovascular system – independently from angiotensin II. Recently a novel sites of aldosterone biosyntesis and a new localisations of aldosterone receptors were recognized. These new findings allow to use more widely mineralocorticoid receptors blockers in the treatment of different cardiovascular diseases.

W 1954 r. Simpson i wsp. opublikowali pracę, w której opisali strukturę chemiczną aldosteronu. Rok później Wettstein dokonał syntezy tego hormonu. Poznano właściwości aldosteronu, który wytwarzany jest w warstwie kłębkowatej nadnerczy i odgrywa istotną rolę w regulacji gospodarki wodno-elektrolitowej.
Na przestrzeni ponad 50 lat dokonał się niesłychanie dynamiczny postęp w poznaniu nowych właściwości biologicznych aldosteronu. W zasadniczy sposób zmienił nasze dotychczasowe zapatrywania na patofizjologiczne znaczenie tego hormonu (ryc. 1) (1, 2, 3, 4, 5).
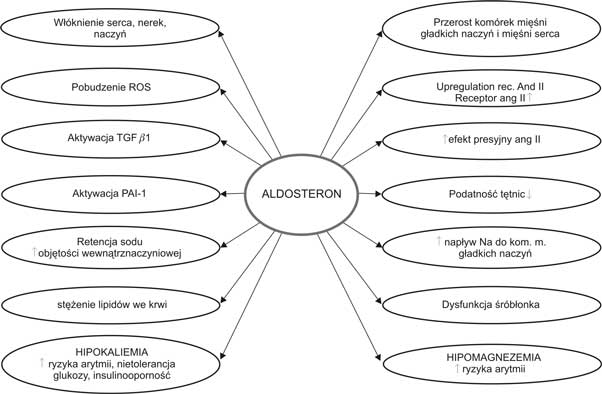
Ryc. 1. Następstwa działania aldosteronu.
Wykazano, że aldosteron jest wytwarzany także poza nadnerczami i może wywoływać bezpośredni uszkadzający wpływ na układ sercowo-naczyniowy niezależnie od angiotensyny II. Wykazano obecność receptorów dla aldosteronu poza obrębem nerek w sercu, w naczyniach i w mózgu. Działanie aldosteronu przez wewnątrzkomórkowe receptory dla mineralokortikoidów (MR) to klasyczny mechanizm na poziomie jądrowego materiału genetycznego. Jego charakterystyczną cechą jest opóźnione działanie. Pod koniec lat dziewięćdziesiątych ubiegłego stulecia opisano szybki efekt aldosteronu. Różni się od wyżej wspomnianego działania i nie polega na interakcji z genomem komórki (6, 7). Badania doświadczalne dostarczyły dowodów, że aldosteron jest wytwarzany w obrębie ściany naczyń – w śródbłonku i komórkach mięśni gładkich naczynia (8, 9). Istnieją badania wskazujące, że aldosteron może być wytwarzany w obrębie serca, a także w ośrodkowym układzie nerwowym (10, 11, 12). Wiele prac doświadczalnych i klinicznych poświęcono wyjaśnieniu mechanizmów odpowiedzialnych za rozwój zmian w układzie sercowo-naczyniowym pod wpływem aldosteronu.
Godne odnotowania są badania Brilla i Webera pochodzące z wczesnych lat dziewięćdziesiątych ubiegłego wieku (13). Autorzy wykazali, że u szczurów po jednostronnej nefrektomii pozostających na diecie bogatosodowej, 8. tygodniowy wlew aldosteronu powodował wzrost zawartości kolagenu w mięśniu sercowym. Efektu tego nie obserwowano u zwierząt, u których ograniczono dowóz sodu. Uzyskane wyniki wskazywały, że aldosteron przyczynia się do włóknienia w mięśniu serca. Wpływ ten ujawniał się jedynie w warunkach nadmiernej podaży sodu. Ci sami autorzy stwierdzili, że spironolakton zapobiegał włóknieniu mięśnia serca u badanych zwierząt, nie wpływając na wartości ciśnienia krwi (14).
Na uwagę zasługują badania przeprowadzone u szczurów SHR, u których spironolakton podawany przez 4 miesiące zmniejszał zawartość kolagenu w ścianie aorty. Ulegał też obniżeniu stosunek kolagenu do elastyny w ścianie naczynia. Uzyskane wyniki sugerują, że blokada receptora aldosteronu może przyczynić się do zmniejszenia sztywności ściany naczyniowej (9). Warto przytoczyć badania, które wykazały, że aldosteron zwiększa ekspresję receptorów angiotensyny II, nasila efekt presyjny angiotensyny II i przyczynia się do przerostu komórek mięśni gładkich w ścianie naczynia (15).
Ciekawe są badania Rocha i wsp. przeprowadzone u szczurów SHRSP otrzymujących sól. Wykazano, że spironolakton wywierał ochronny wpływ na wystąpienie zmian naczyniowych w nerkach i znacząco zmniejszał wydalanie albumin z moczem. Uzyskane wyniki wskazują na uszkadzający wpływ aldosteronu na naczynia nerkowe w doświadczalnym modelu nadciśnienia tętniczego (16).
Interesujące są również ostatnio opublikowane badania, w których wykazano, że u szczurów pozostających na diecie bogatosodowej wlew aldosteronu powodował uszkodzenie podocytów, stanowiących istotny element bariery przesączania kłębuszkowego. Towarzyszył temu wzrost ciśnienia krwi i pojawienie się białkomoczu. Antagonista receptora aldosteronu – eplerenon zapobiegał wystąpieniu tych zmian (17).
W 2006 r. wykazano po raz pierwszy tzw. szybki efekt działania aldosteronu na układ naczyniowy u ludzi. W warunkach upośledzonej funkcji śródbłonka spowodowanej zahamowaniem syntazy tlenku azotu, aldosteron wywierał działanie zwężające tętniczki nerkowe, przyczyniając się do wzrostu oporu obwodowego (18). Wykazano niekorzystny wpływ aldosteronu na komórki śródbłonka naczyniowego pochodzące z żył i tętnic wieńcowych człowieka. Eplerenon zapobiegał powstaniu tych zmian (19). Wykazano też w badaniach doświadczalnych, że aldosteron zmniejsza aktywność syntazy tlenku azotu i w ten sposób wywiera niekorzystny wpływ na ścianę naczynia (20).
Wspomnieć należy o badaniach przeprowadzonych na transgenicznym modelu myszy. U tych zwierząt nadmierna ekspresja syntazy aldosteronu powoduje zwiększone stężenie tego hormonu w sercu. Badania te wykazały zaburzenia w krążeniu wieńcowym bez jednoznacznych zmian struktury i czynności mięśnia serca. Są to pierwsze obserwacje wskazujące, że wytwarzany w mięśniu serca aldosteron może upośledzać adaptację krążenia wieńcowego do zwiększonego zapotrzebowania na krew (21).
Ciekawa jest obserwacja, że aldosteron upośledza wytwarzanie komórek progenitorowych pochodzących ze szpiku kostnego, odgrywających ważną rolę w zachowaniu integralności śródbłonka (22). Przytoczone fakty ukazały nowy, bardzo interesujący mechanizm działania aldosteronu niezależny od jego klasycznego mechanizmu nerkowego.
Na szczególne zainteresowanie zasługują badania, w których stwierdzono, że aldosteron wywiera stres oksydacyjny, wykazuje działanie prozapalne i prozakrzepowe (23, 24).
Jak już wspomniano, wykazano obecność receptorów dla aldosteronu w ośrodkowym układzie nerwowym. Antagoniści tych receptorów zmniejszają reakcje presyjne, diurezę i wydalanie elektrolitów z moczem. Podanie aldosteronu do ośrodkowego układu nerwowego u zwierząt doświadczalnych powodowało wzrost ciśnienia krwi, któremu zapobiegała blokada receptorów aldosteronu (25). Interesujące też są badania sugerujące, że aldosteron zmniejsza aktywność baroreceptorów (26, 27).
Właściwości biologiczne aldosteronu od dawna sugerują możliwość jego udziału w patogenezie nadciśnienia tętniczego. Dotychczasowe badania nie dostarczyły jednak jednorodnych wyników.
W drugiej połowie lat 50. ubiegłego stulecia Genest i wsp. wykazali, że wydalanie aldosteronu w moczu u chorych z nadciśnieniem tętniczym pierwotnym jest wzmożone. W oparciu o uzyskane wyniki określili nadciśnienie tętnicze pierwotne jako stan łagodnego hiperaldosteronizmu (28). W kilka lat później grupa badaczy pod kierunkiem J.H. Laragh w Columbia Presbyterial Medical Center w Nowym Jorku wykazała po raz pierwszy, że sekrecja aldosteronu jest wybitnie wzmożona u chorych ze złośliwym nadciśnieniem tętniczym (29, 30). Nie stwierdzono natomiast wzrostu sekrecji tego hormonu u chorych z niepowikłanym nadciśnieniem pierwotnym. Trzeba dodać, że po raz pierwszy zastosowano wówczas opracowaną kilka lat wcześniej przez Ulicka i Liebermana czułą metodę, która pozwoliła na określenie sekrecji aldosteronu przez korę nadnerczy (secretion rate) (31). Sformułowano hipotezę, że zwiększona sekrecja aldosteronu u chorych z nadciśnieniem złośliwym jest spowodowana zwiększonym wytwarzaniem reniny. W wyniku ciężkiego uszkodzenia nerek nie dochodzi do odpowiedniego zwiększenia zwrotnego wchłaniania sodu w odpowiedzi na wzmożoną sekrecję aldosteronu. Uniemożliwia to zwiększenie objętości wewnątrznaczyniowej i zahamowanie na drodze ujemnego sprzężenia zwrotnego sekrecji reniny. Jednoczesny wzrost reniny i aldosteronu nasila nadciśnienie tętnicze i pogłębia zmiany w nerkach, które z kolei nasilają zaburzenia humoralne. Powstaje mechanizm błędnego koła.
Z kolei badania własne (W.J.) przeprowadzone w II Klinice Chorób Wewnętrznych wykazały podwyższone wydalanie aldosteronu u chorych z nadciśnieniem pierwotnym. Trzeba też wspomnieć, że w piśmiennictwie donoszono także o obniżonym wydalaniu aldosteronu z moczem u chorych z nadciśnieniem pierwotnym (33). Godne uwagi są badania Schlaicha i wsp. przeprowadzone u osób z prawidłowym ciśnieniem krwi i obciążającym wywiadem rodzinnym w kierunku nadciśnienia tętniczego. Stwierdzono, że zwiększenie podaży sodu nie wywoływało u nich wyraźnego obniżenia sekrecji aldosteronu, a angiotensyna II powodowała nadmiernie zwiększone i długo utrzymujące się wytwarzanie aldosteronu. Zmian tych nie obserwowano u osób bez obciążającego wywiadu rodzinnego. Zdaniem autorów, stwierdzane zmiany mogą predysponować do rozwoju nadciśnienia tętniczego.
Bardzo interesujące są badania prowadzone w ramach Framingham Offspring Study (35). Obejmowały one 1688 osób z prawidłowym ciśnieniem krwi, a czas obserwacji wynosił 4 lata. Znaczenie tych badań podkreśla ich prospektywny charakter oraz dużą liczebność badanej populacji. Wykazano, że większe stężenie aldosteronu w osoczu, mieszczące się jeszcze w obrębie fizjologicznego zakresu normy (IV kwartyl vs I kwartyl), usposabia do rozwoju nadciśnienia tętniczego. Wyrażono przypuszczenie, że wzrost ciśnienia krwi mógł być związany z niekorzystnym, uszkadzającym wpływem aldosteronu na układ naczyniowy, retencją sodu, nasileniem działania angiotensyny II, a także od ośrodkowego działania aldosteronu. Wzięto też pod uwagę możliwość istnienia u niektórych osób subklinicznie przebiegającego hiperaldosteronizmu. Zarówno w dyskusji autorów badań, jak i w komentarzu redakcyjnym podkreślono znaczenie patofizjologicznego działania aldosteronu w zależności od dowozu sodu w diecie (36).
Przy zmniejszonym dowozie sodu do ustroju sekrecja aldosteronu wzrasta – nie towarzyszy temu wzrost ciśnienia krwi. W tej sytuacji aldosteron służy utrzymaniu homeostazy. Przy nadmiernej podaży sodu, kiedy zawodzą mechanizmy obniżające sekrecję aldosteronu, hormon ten przyczynia się do rozwoju nadciśnienia tętniczego i zmian w układzie sercowo-naczyniowym.
Trafnie sformułowano pytanie dotyczące relacji sód – aldosteron jako „les liaisons dangereuse?” Zwrócono uwagę, że w populacji Indian Yanomamo, spożywających pożywienie o bardzo małej zawartości soli, obserwuje się znaczny wzrost stężenia aldosteronu w osoczu. Przy czym nie stwierdza się nadciśnienia tętniczego (37). Obserwacja ta podkreśla celowość badań nad rolą aldosteronu w rozwoju nadciśnienia tętniczego w różnych pod względem etnicznym populacjach.
Istnieją badania wskazujące, że u osób z otyłością trzewną i nadciśnieniem tętniczym stężenie aldosteronu w osoczu jest podwyższone w porównaniu z osobami z prawidłową masą ciała i prawidłowym ciśnieniem krwi. Badania doświadczalne wykazały, że utleniona pochodna kwasu linolowego (EKODE) wytwarzana w adipocytach pobudza sekrecję aldosteronu w komórkach kory nadnerczy szczura (38, 39). Stwierdzono też, że u ludzi stężenie EKODE w osoczu wykazywało korelację ze stężeniem aldosteronu. Zależność ta była bardziej wyrażona u osób rasy czarnej, u których obserwowano korelację stężenia EKODE z ciśnieniem krwi skurczowym.
Przytoczone badania ukazują nowy mechanizm regulacji sekrecji aldosteronu. Rzucają też nowe światło na możliwy udział tego hormonu w rozwoju nadciśnienia u osób otyłych (40, 41, 42).
Warto w tym miejscu odnotować badania autorów amerykańskich obejmujących 397 Afroamerykanów. Stwierdzono, że stężenie aldosteronu w osoczu wykazywało istotną korelację z obwodem talii, stężeniem cholesterolu, triglicerydów, insuliny i wielkością wskaźnika insuliooporności. Spośród osób badanych u 17% stwierdzono zespół metaboliczny. W tej podgrupie chorych stężenie aldosteronu było podwyższone, a aktywność reninowa osocza nie była zmieniona. Uzyskane wyniki sugerują, że związek aldosteronu z ciśnieniem krwi i zaburzeniami metabolicznymi może mieć znaczenie w rozwoju nadciśnienia tętniczego u osób otyłych w badanej populacji Afroamerykanów (43).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Young MJ, Funder JW: Mineralocorticoid receptors and pathophysiological roles for aldosterone In the cardiovascular system. J Hypertens 2002; 20, 1465-1468.
2. Rocha R, Funder JW: The pathophysiology of aldosterone in the cardiovascular system. Ann NY Acad Sci 2002; 970, 89-100.
3. Sanz-Rosa D et al.: Participation of aldosterone in the vascular inflammatory response of spontaneously hypertensive rats: role of the NFK B/KB system. J Hypertens 2005; 23, 1167-1172.
4. Rossi GP et al.: Aldosterone as a cardiovascular risk factor. Trends in Endocr and Metab 2005; 16, 104-107.
5. Fuller PJ, Young MJ: Mechanisms of mineralocorticoid action. Hypertension 2005; 46, 1227-1235.
6. Christ M et al.: Rapid effects of aldosterone on sodium transport in vascular smooth muscle cells. Hypertension 1995; 25, 117-123.
7. Losel R et al.: Rapid effects of aldosterone on vascular cells: clinical implications. Steroids 2004; 69, 575-578.
8. Takeda Y et al.: Production of aldosterone In isolated rat blood vessels. Hypertension 1995. 25, 170-173.
9. Takeda Y et al.: Vascular aldosterone In genetically hypertensive rats. Hypertension 1997; 29, 45-48.
10. Dekcayare C et al.: Cardiac aldosterone production and ventricular remodeling. Kidney Int 2000; 57, 1346-1351.
11. Takeda Y et al.: Cardiac aldosterone production in genetically hypertensive rats. Hypertension 2000; 36, 495-500.
12. Gomez-Sanchez CE et al.: Aldosterone biosynthesis in the rat brain. Endocrinology 1997; 138, 3369-2273.
13. Brilla CG, Weber KT: Mineralocorticoid excess, dietary sodium and myocardial fibrosis. J Lab Clin Med 1992; 120, 891-901.
14. Brilla CG, Matsubara LS, Weber KT: Antifibrotic effects of spironolactone in preventing myocardial fibrosis in systemic arterial hypertension. Am J Cardiol 1993; 71, 12A-16A.
15. Ulian ME, Schelling JR, Linas SL: Aldosterone enhances angiotensin II receptor binding and inosibol phosphate responses. Hypertension 1992; 20, 67-73.
16. Rocha R et al.: Role of aldosterone in renal vascular injury in stroke-prone hypertensive rats. Hypertension 1999; 33 (II), 232-237.
17. Shibata S et al.: Podocyte as target for aldosterone, role of oxidative stress and Sg K1. Hypertension 2007; 49, 355-364.
18. Schmidt BMW eet al.: Rapid nongenomic effects of aldosterone on the renal vasculature in humans. Hypertension 2006; 47, 650-656.
19. Hillebrand V et al.: Dose-dependent endothelial cell growth and stiffening by aldosterone protection by eplerenone. J Hypertens 2007; 25, 639-647.
20. Nagata D et al.: Molecular mechanizm of the inhibitory effect of aldosterone on endothelial NO synthase activity. Hypertension 2006; 48, 165-171.
21. Garnier A et al.: Cardiac specific increase In aldosterone production induces coronary dysfunction In aldosterone synthase – transgenic mice. Circulation 2004; 110, 1819-1825.
22. Marumo T et al.: Aldosterone impairs bone-marrow-derived progenitur cell formation. Hypertension 2006; 48, 490-496.
23. Brown NJ et al.: Aldosterone modulates plasminogen activator inhibitor-1 and glomerulosclerosis In vitro. Kidney Int 2000; 58, 1219-1227.
24. Brown NJ: Aldosterone and vascular inflammation. Hypertension 2008; 51, 161-167.
25. Gomez-Sanchez EP: Mineralocorticoid modulation of central control of blood pressure. Steroids 1995; 60, 69-72.
26. Wang W: Chronic Administration of aldosterone depresses baroreceptor reflex function in the dog. Hypertension 1994; 24, 571-575.
27. Yee KM, Struthers AD: Aldosterone blunts baroreflex response in man. Clin Sci 1998; 95, 687-692.
28. Genest J et al.: Human arterial hypertension: a state of mild chronic hyperaldosteronism? Science 1956; 123, 503-505.
29. Laragh JH et al.: Aldosterone secretion and primary and malignant hypertension. J Clin Invest 1960; 39, 1091-1106.
30. Laragh JH et al.: Electrolyte metabolizm and aldosterone secretion in benign and malignant hypertension. Ann Intern Med 1968; 53, 259-279.
31. Ulick S, Laragh JH, Lieberman S: The isolation of a urinary metabolite of aldosterone and ist use to measuire the rate of secretion of aldosterone by the adrenal cortex in man. Tr A Am Physicians 1958; 71, 225.
32. Januszewicz W: Wydalanie aldosteronu w moczu u chorych z nadciścnieniem tętniczym. Pol Arch Med. Wewn 1965; 35, 47-52.
33. Walker WG et al.: Relation between blood pressure and rennin substrate, angiotensin II, aldosterone and urinary sodium and potassium in 574 ambulatory subjects. Hypertension 1979; 1, 287-291.
34. Schlaich MP et al.: Altered aldosterone response to salt intake and angiotensin II infusion in young normotensive men with parental history of arterial hypertension. J Hypertens 2002; 20, 117-121.
35. Vason RS et al.: Serum aldosterone and the incidence of hypertension in nonhypertensive persons. N Engl J Med 2004; 351, 33-41.
36. Dluhy RG, Williams GH: Aldosterone – villan or bystander. N Engl J Med 2004; 351, 8-10.
37. Oliver WJ, Cohen EL, Neel JW: Blood pressure, sodium intake, and sodium related hormones in Yanomamo Indians, a „no-salt” culture. Circulation 1975; 52, 146-156.
38. Goodfriend TL, Ball DL, Egan BM: Epoxy-keto derivative of linoleic acid stimulates aldosterone secretion. Hypertension 2004; 43, 358-363.
39. Goodfriend TL, Egan BM, Kelly DE: Aldosterone and obesity. Endocr Res 1998; 24, 789-796.
40. Hyla-Klekot L, Pulcer B, Kokot F: Układ renina-angiotensyna-aldosteron (RAA) – nowe aspekty patogenetyczne i lecznicze. Część I. Prorenina-renina i jej receptory. Konwertaza 2 angiotensyny 1-10, angiotensyna 1-7 i jej receptor, trzewna tkanka tłuszczowa jako źródło syntezy ogniw układu RAA. Nadciśnienie Tętnicze 2007; 11, 242-247.
41. Januszewicz W, Januszewicz A, Prejbisz A: Udział aldosteronu w patogenezie nadciśnienia tętniczego – implikacje praktyczne. Terapia 2008; 211/212/23-26.
42. Redon J et al.: Mechanisms of hypertension In the cardiometabolic syndrome. J Hypertens 2009; 27, 441-451.
43. Kidambi S et al.: Association of adrenal steroids with hypertension and the metabolic syndrome. Hypertension 2007; 29, 704-711.
44. Keidar S et al.: Aldosterone administration to mice stimulates macrophage NADPH oxidase and increases atherosclerosis development: a possible role for angiotensin-converting enzyme and the receptors for angiotensin II and aldosterone. Circulation 2004; 109, 2213-2220.
45. Kokot F et al.: Diagnostische Bedentung der Reninaktivitäts – bestimmung im Plasma von hypertonikern. Zschr Inn Med 1968; 23, 105-109.
46. Kokot F et al.: Der primare Aldosteronismus im Bilde eigener Beobachtungen Zschr Inn Med. 1971; 26, 601-604.
47. Kokot F, Kuska J: About some aspects of plasma renin activity estimations in hypertensive patients. Cor Vasa 1972; 14, 22-32.
48. Hartwig W: Endokrynologia kliniczna. Państwowy Zakład Wydawnictw Lekarskich, Warszawa 1989.
49. Kuska J et al.: Rodzaj patologii nadnerczowej a stan biochemiczny i kliniczny chorych z zespołem pierwotnego hiperaldosteronizmu. Endokr Pol 1981; 32, 403-413.
50. Stowasser M et al.: High rate of detection of primary aldosteronism, including surgically treatable forms, after „non selective” screening of hypertensive patients. J Hypertens 2003; 21, 2149-2157.
51. Rossi GP, Pessina AC, Heagerty AM: Primary aldosteronism: an update on screening, diagnosis and treatment. J Hypertens 2008; 26, 613-621.
52. Mulatero P, Morello F, Veglio F: Genetics of primary aldosteronism. J Hypertens 2004; 22, 663-670.
53. Milliez P, Girerd X, Plouin PF: Evidence for an increased rate of cardiovascular events in patients with primary aldosteronism. J Am Coll Cardiol 2005; 45, 1243-1248.
54. Rossi GP et al.: Renal damage in primary aldosteronism. Results of the PAPY study. Hypertension 2006; 48, 232-238.
55. Holaj R et al.: Increased intima-media thickness of the common carotid artery in primary aldosteronism in comparison with essential hypertension. J Hypertens 2007; 25, 1451-1457.
56. Bernini G et al.: Arteria stiffness, infima-media thickness and carotid artery fibrosis In patients with primary aldosteronism. J Hypertens 2008; 26, 2399-2405.
57. Dobrucki T et al.: Aldosteron – hormon o nowym obliczu. Nadciśnienie Tętnicze 2003; 7, 271-279.
58. Prejbisz A et al.: Diagnostyka pierwotnego hiperaldosteronizmu – dyskusja wciąż trwa. Część I. Nadciśnienie Tętnicze 2004; 8, 205-214.
59. Prejbisz A et al.: Diagnostyka pierwotnego hiperaldosteronizmu – dyskusja wciąż trwa – część II. Nadciśnienie Tętnicze 2004; 8, 293-296.
60. Głuszek J: Aldosteron – czynnik ryzyka zmian w układzie sercowo-naczyniowym. Korzyści wynikające z blokady receptorów aldosteronu. Terapia 2006; 181/182, 15-19.
61. Kokot F, Hyla-Klekot L: Zespół pierwotnego hiperaldosteronizmu – dlaczego rozpoznanie jest trudne? Nadciśnienie Tętnicze 2008; 12, 79-79.
62. Pitt B et al.: The effect of spironolactone on morbidity and mortality In patients with severe heart failure. N Engl J Med 1999; 341, 709-717.
63. Januszewicz W, Prejbisz A, Januszewicz A: Eplerenon. Prob Ter Monitor 2004; 15, 114-126.
64. Pitt B et al.: Eplerenone, a selective aldosterone blocker, In patients with left ventricular dysfunction after myocardial infarction. N Engl J Med 2003; 348, 1309-1321.
65. Shah NC et al.: Spironolactone has antiarrhytmic activity in ischaemic cardiac patients without cardiac failure. J Hypertens 2007; 25, 2345-2351.
66. Krakoff LR: Is aldosterone a pro-arrhytmic hormone. J Hypertens 2007; 25, 2207-2208.
67. Pimenta E et al.: Aldosterone excess and resistant to 24h blood pressure control. J Hypertens 2007; 25, 2131-2137.
68. Chapman N et al.: Anglo-Scandinavian Cardiac Outcomes Trial Investigators. Effect of spironolactone on blood pressure in subjects with resistant hypertension. Hypertension 2007; 49, 839-845
69. Zannad F: Aldosterone antagonist therapy in resistant hypertension 2007; 25, 747-750.

