© Borgis - Postępy Nauk Medycznych 10/2009, s. 840-847
*Zbigniew Wygoda, Andrea d´Amico, Barbara Jarząb
Tomografia emisji pozytonów (PET) i jej zastosowanie do wykrywania, lokalizacji i monitorowania guzów gruczołów wydzielania wewnętrznego**
Positron emission tomography (PET) and its role in the diagnosis, localization and monitoring of the endocrine gland tumors
Zakład Medycyny Nuklearnej i Endokrynologii Onkologicznej, Centrum Onkologii – Instytut im. M. Skłodowskiej-Curie, Oddział w Gliwicach
Kierownik Zakładu: prof. dr hab. med. Barbara Jarząb
Streszczenie
W pracy przedstawiono w skrócie aktualne zastosowanie tomografii emisji pozytonów w diagnostyce gruczołów wydzielania wewnętrznego. We wstępie omówiono zasadę obrazowania przy użyciu techniki PET oraz najczęściej stosowane radiofarmaceutyki pozytonowe, przedstawiono również zasadę działania współczesnych hybrydowych skanerów PET-TK oraz zalety ich stosowania. Następnie omówiono wykorzystanie tomografii PET w guzach nowotworowych gruczołów wewnątrzwydzielniczych. Szczególnie skupiono się na przedstawieniu znaczenia badania PET w diagnostyce nowotworów tarczycy z krótkim omówieniem roli badania w poszczególnych podtypach rakach gruczołu tarczowego. Opisano także wykorzystanie tomografii PET w ocenie guzów neuroendokrynnych przewodu pokarmowego, guzów chromochłonnych nadnerczy i przyzwojaków, raka kory nadnerczy, przedstawiono także pokrótce rolę badania w diagnostyce nowotworów jajnika i jądra. W pracy skupiono się szczególnie na omówieniu wskazań do badania PET w kontekście możliwości i ograniczeń metody.
Summary
In this paper the actual applications of positron emission tomography in diagnostics of endocrine glands tumour were shortly presented, including the imaging basis by using PET technique, the most popular radiopharmaceuticals, as well as construction and functioning of hybrid PET scanner. The paper describes the usefulness of PET tomography in endocrine glands neoplasms. Moreover, special focus was given to the significance of PET examination in thyroid neoplasms diagnostics by describing shortly its role in each subtypes of the thyroid cancers. The usefulness of PET tomography in the assessment of neuroendocrine tumors of the gastrointestinal tract, adrenal phaeochromocytomas and paragangliomas, adrenocortical cancers were also presented. The role of PET examinations in the ovarian and testicular cancers was also shortly described. The aim of this paper was to show the indications for PET examinations in relations to its possibilities and limitations.

WIADOMOŚCI OGÓLNE
Pozytonowa tomografia emisyjna (właściwie: tomografia emisji pozytonów, PET) jest metodą diagnostyczną, wykorzystującą do obrazowania izotopy promieniotwórcze emitujące pozytony – antycząstki dla elektronów. Emiter pozytonów łączony jest z substancją, której rozkład w ciele lub metabolizm zamierza się obrazować; emitowane przez niego pozytony anihilują z elektronami, wytwarzając dwa koincydentne kwanty gamma poddawane detekcji w tomografie PET. Niezbędny jest tu pierścień detektorów, zawierających kryształy scyntylacyjne i fotopowielacze połączone układem koincydencji, a nie zwykła głowica do gamma detekcji, dlatego tomograf PET nazywany jest skanerem, a nie gamma-kamerą (ryc. 1).
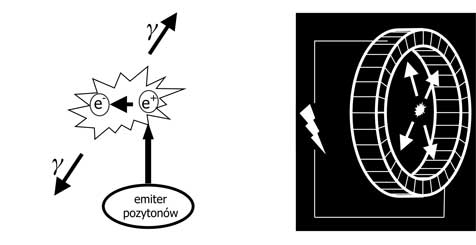
Ryc. 1. a) pozyton ulega anihilacji z elektronem, emitując dwa koincydentne kwanty gamma o energii 511 keV; b) tomograf PET posiada koncentryczny pierścień detektorów połączonych układami koincydencji, co pozwala na rejestrowanie obydwu jednoczasowych (koincydentnych) kwantów gamma i umożliwia dokładne umiejscowienie punktu, z którego emitowane były pozytony.
Istotną zaletą stosowania znaczników pozytonowych w stosunku do klasycznych gamma-emiterów stosowanych w gamma kamerach jest fakt, że są one izotopami pierwiastków tworzących w naturze związki organiczne, jak węgiel, tlen, azot, czy też łatwo reagujących ze związkami organicznymi, jak fluor. Umożliwia to wykorzystanie w tomografii PET całej gamy związków organicznych, jak cukry, aminokwasy, hormony itd. Wadą izotopów pozytonowych jest z reguły ich krótki lub bardzo krótki okres półtrwania, wynoszący w przypadku najpopularniejszego dziś fluoru 18F niecałe dwie godziny (110 min), a dla węgla 11C-20 min. Cyklotron produkujący izotopy pozytonowe musi znajdować się więc w stosunkowo niedużej odległości od skanera PET, co pozwala na dostarczenie do pracowni wystarczająco wysokiej aktywności i wykonanie badań. W przypadku węgla 11C czy azotu 13N cyklotron musi się znajdować na terenie szpitala.
Radiofarmaceutyki PET mogą wiązać się z cząsteczkami białek na powierzchni komórki (interakcja ligand-receptor) lub w ich wnętrzu. Często radiofarmaceutyki pozytonowe są substratami dla enzymów wewnątrzkomórkowych bądź inkorporacji ich do wnętrza komórki i poddaniu specyficznemu procesowi metabolicznemu (enzymatycznemu).
Najpopularniejszym dziś radiofarmaceutykiem PET jest fluorodeoksyglukoza (FDG), analog glukozy wyznakowany przez fluor pozytonowy 18F. Tomografia PET wykonana po podaniu FDG obrazuje dystrybucję i metabolizm tego radiofarmaceutyku, co odzwierciedla metabolizm glukozy w ciele. Wykorzystuje się tutaj tzw. pułapkę metaboliczną: pochłaniana przez komórki FDG ulega przekształceniu do 18F-fluorodeoksyglukozo-6-fosforanu (proces katalizowany przez heksokinazę), ale nie podlega dalszym przemianom, co powoduje kumulację radiofarmaceutyku w narządach intensywnie metabolizujących glukozę, tym bardziej, że fosfopochodna jest zbyt hydrofilna, by dyfundować przez błonę komórkową (ryc. 2).
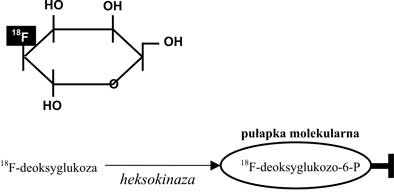
Ryc. 2. a) deoksyglukoza wyznakowana izotopem fluoru 18F; b) 18F-fluorodeoksyglukoza jest przekształcana do 18F-fluorodeoksyglukozo-6-fosforanu, który nie podlega dalszym przemianom metabolicznym i nie może opuścić komórki.
Tomografia PET znalazła dziś główne zastosowanie w diagnostyce nowotworów – ocenia się, że do 90% badań wykonuje się ze wskazań onkologicznych, pozostałe dotyczą głównie neurologii i kardiologii. Jak wspomniano, znacznikiem najczęściej obecnie wykorzystywanym jest opisana wcześniej 18F-fluorodeoksyglukoza. Tomografia PET z zastosowaniem FDG obrazuje zdrowe narządy charakteryzujące się wysokim metabolizmem glukozy (serce, mózg) (ryc. 3), a także ogniska zapalne, również cechujące się zwiększonym zużyciem glukozy. Niemniej, w guzach złośliwych metabolizm glukozy jest tak wysoki, że niejednokrotnie rozpoznanie nowotworu złośliwego jest niemal pewne. W przyszłości należy spodziewać się szerokiego wprowadzenia całej gamy znaczników pozytonowych, które pozwolą lepiej scharakteryzować funkcje guza nowotworowego, np. 11C-metionina w diagnostyce ośrodkowego układu nerwowego, 11C-octany lub 18F-cholina w raku stercza, 86Y-DOTATOC w guzach neuroendokrynnych i inne.
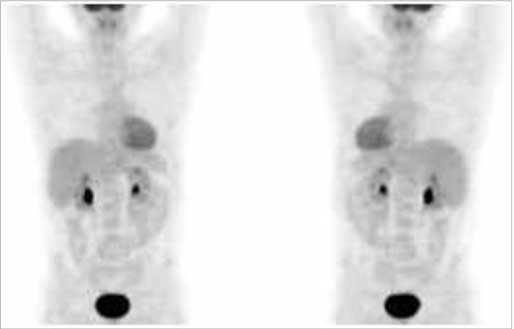
Ryc. 3. Prawidłowy obraz badania PET (widoczna fizjologiczna dystrybucja znacznika – obserwuje się gromadzenie radioznacznika w mięśniu sercowym, wątrobie, miedniczkach nerkowych i pęcherzu).
Niektóre z nich będą też używane w obrazowaniu tych raków, w których FDG nie znajduje zastosowania albo ze względu na niski metabolizm w guzie, albo ze względu na wysokie gromadzenie w sąsiadujących zdrowych narządach. Istotne jest jednak, że aczkolwiek w badaniu PET najczęściej jest oceniany metabolizm glukozy (FDG-PET), dla obrazowania guzów wykazujących niewielki wychwyt FDG czasem częściej stosuje się radiofarmaceutyki alternatywne, jak wspomniane wcześniej znakowane octany lub cholina w nowotworach stercza. Możliwe jest również badanie stopnia utlenowania guza i zróżnicowania zawartości tlenu w obrębie nowotworu (przy użyciu znaczników hipoksji), co pozwala na indywidualizację terapii.
SKANERY HYBRYDOWE PET-CT
Przełomem ostatnich lat stało się wprowadzenie tzw. skanerów hybrydowych, stanowiących połączenie dwóch tomografów: PET oraz helikalnego tomografu komputerowego. Pozwoliło ono na uzyskiwanie obrazów łączących informację anatomiczną z informacją czynnościową (ryc. 4) i stanowiło istotny postęp w diagnostyce nowotworów, gdyż pozwoliło odróżnić, kiedy ognisko gromadzenia odpowiada określonej strukturze anatomicznej (guzowi lub przerzutowemu węzłowi chłonnemu). Szeroko wprowadzono technikę hybrydową PET-TK do planowania radioterapii nowotworów, gdzie widać obecnie wyraźnie przejście od terapii opartej o anatomiczny obraz guza (ocena tzw. GTV – gross tumour volume) do obrazowania biologicznego guza (ocena tzw. BTV – biological tumour volume). Stanowi to istotną zmianę w podejściu do terapii nowotworów. Praktycznie wszystkie produkowane obecnie skanery PET są skanerami hybrydowymi; co istotne, wszystkie dostępne w Polsce skanery są skanerami PET-TK. Należy więc pamiętać, że podsumowania z piśmiennictwa dotyczą często skanerów pierwszej generacji, gdyż dopiero teraz zaczynają się ukazywać podsumowania badań wykonanych za pomocą techniki PET-TK. Dlatego niektóre ograniczenia techniki PET, wynikające z tych wcześniejszych analiz, są już dość nieaktualne. Przy omówieniu wskazań do badania PET-TK w najważniejszych nowotworach endokrynnych używano skrótu PET, rozumiejąc pod tym pojęciem badanie hybrydowe, które obecnie winno być standardem.
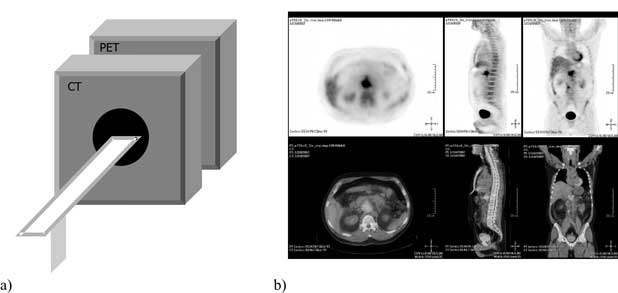
Ryc. 4. a) schematyczna budowa skanera hybrydowego – dwa połączone tomografy; b) obraz uzyskiwany ze skanera hybrydowego pozwala na dowolną obróbkę obrazów PET i TK oraz ich fuzję sprzętową (u góry badanie PET w trzech projekcjach, u dołu badanie fuzyjne w trzech projekcjach).
TOMOGRAFIA PET W GUZACH GRUCZOŁÓW WYDZIELANIA WEWNĘTRZNEGO
Większość agresywnych guzów nowotworowych wykazuje wysoki metabolizm glukozy, stąd dzięki zwiększonemu wychwytowi FDG możliwe jest obrazowanie stanu zaawansowania choroby (lokalizacji ognisk pierwotnych, liczby wielkości i lokalizacji przerzutów). To stwierdzenie odnosi się także do najbardziej agresywnych raków gruczołów wydzielania wewnętrznego, w tym raka anaplastycznego tarczycy, raka nadnerczy czy niskozróżnicowanych raków neuroendokrynnych. Niemniej, większość przypadków raka tarczycy czy raków neuroendokrynnych to raki wysokozróżnicowane, w których, mimo ich ewidentnie złośliwego charakteru, metabolizm glukozy nie jest dostatecznie wysoki, żeby badanie FDG mogło być zastosowane rutynowo. W tych nowotworach, podobnie jak w czynnych hormonalnie gruczolakach, szczególnie istotne będzie zastosowanie charakterystycznych dla nich znaczników, jak 11C-5-OH-tryptofan, 18F-DOPA w guzach chromochłonnych czy 11C-etomidat w czynnych gruczolakach nadnercza.
Rak tarczycy
Rak tarczycy występuje najczęściej w postaci wysokozróżnicowanego raka brodawkowatego (>70% wszystkich przypadków) lub pęcherzykowego (około 10-15%). Rak rdzeniasty tarczycy jest nowotworem rzadszym, stanowi około 5-7%. Najrzadziej obserwuje się najbardziej agresywne raki anaplastyczne. Leczenie tych nowotworów zawsze obejmuje wykonanie zabiegu operacyjnego, wraz z uzupełniającą terapią radiojodem w przypadku raków brodawkowatych i pęcherzykowych. Wykonanie scyntygrafii jodowej całego ciała, szczególnie po dawce terapeutycznej, pozwala na ocenę zaawansowania choroby i wykrycie wznowy lub jodochwytnych przerzutów odległych.
Wskazania do wykonania badania PET u chorych z rakiem tarczycy są zróżnicowane w zależności od histotypu, a jeżeli nie jest on znany, opierają się głównie na doświadczeniu w rakach wysokozróżnicowanych (1, 2). Generalnie, w przypadku raków zróżnicowanych, badanie FDG-PET wykonuje się u chorych z podejrzeniem wznowy lub rozsiewu nowotworu, stwierdzanym na podstawie wzrostu stężenia tyreglobuliny, u których w innych badaniach diagnostycznych obrazowych, także w scyntygrafii jodowej, nie udaje się zlokalizować ogniska nowotworu.
Zróżnicowane raki tarczycy (ZRT)
Podstawowym badaniem wizualizacyjnym w zróżnicowanych rakach tarczycy jest badanie ultrasonograficzne szyi, które wskazuje miejsce do biopsji cienkoigłowej i umożliwia wykrycie guza pierwotnego i jego przerzutów do węzłów chłonnych oraz wczesne wykrycie wznowy miejscowej i przerzutów węzłowych. Badanie ultrasonograficzne odgrywa także podstawową rolę w monitorowaniu choroby, razem z badaniem stężenia tyreoglobuliny (Tg). Podstawową zaletą badania jest jego powszechna dostępność, niemniej ocena loży tarczycy lub węzłów chłonnych szyi u chorych uprzednio operowanych nie zawsze jest łatwa i winna być wykonywana przez lekarza posiadającego odpowiednio duże doświadczenie w tym zakresie.
Ocena pierwotnego zaawansowania choroby opiera się, przede wszystkim na scyntygrafii całego ciała wykonanej po leczeniu operacyjnym i podaniu leczniczej dawki jodu radioaktywnego 131I (tzw. scyntygrafia poterapeutyczna po uzupełniającym leczeniu izotopowym zwanym często, lecz niezbyt precyzyjnie, ablacją tarczycy). Scyntygrafia całego ciała po podaniu dużej aktywności jodu promieniotwórczego jest najczulszą metodą wykrywania przerzutów odległych, w tym mikrorozsiewu do płuc, ale dotyczy wyłącznie przerzutów jodochwytnych. Wskazania do scyntygrafii diagnostycznej całego ciała 131I w toku monitorowania po zakończonym leczeniu pierwotnym są obecnie ograniczone do tych chorych, u których obserwuje się wzrost stężenia tyreoglobuliny (Tg). Taka scyntygrafia wykonywana jest po stymulacji rekombinowanym ludzkim TSH (rhTSH) lub endogennym TSH. Jest ona dalej podstawową metodą monitorowania u tych chorych, u których obecność przeciwciał przeciw tyreoglobulinie uniemożliwia wiarygodną ocenę jej stężenia w surowicy krwi.
Badanie TK jest szczególnie istotne u tych chorych, u których przerzuty są niejodochwytne, często zawodzi jednak w początkowym stadium progresji, kiedy wzrost stężenia Tg jest już jej jednoznacznym sygnałem, podobnie lokalizacja wczesnego nawrotu metodą rezonansu magnetycznego nie zawsze jest możliwa. Czułość badania TK jest często ograniczona ze względu na niemożność podania kontrastu, przeciwwskazanego w przypadku chorych, u których rozważa się szybkie leczenie radiojodem. U tych chorych wskazane jest wykonanie badania FDG-PET dla lokalizacji choroby. Ma ono wysoką dokładność diagnostyczną, bliską 93%, jeśli badanie wykonuje się przy użyciu tomografu hybrydowego PET-TK (1). Należy podkreślić, że wykonanie badania PET po stymulacji TSH zwiększa liczbę wykrytych ognisk nowotworowych (2). Wiele danych wskazuje na prognostyczne znaczenie gromadzenia FDG w ogniskach raka, które charakteryzują się agresywnym przebiegiem, niską jodochwytnością, a więc złą odpowiedzią na leczenie izotopowe (2).
Wskazaniem do wykonania badania FDG-PET u chorych ze zróżnicowanym rakiem tarczycy jest sytuacja, w której podejrzewa się nawrót lub rozsiew choroby nowotworowej na podstawie obserwowanego wzrostu stężenia tyreoglobuliny, a jednocześnie nie udało się potwierdzić lokalizacji ognisk raka w żadnym badaniu obrazowym. Ze wskazań indywidualnych można też rozważać badanie PET w obecności przerzutów jodochwytnych przy jednoczesnym podejrzeniu obecności innych przerzutów nie gromadzących radiojodu.
Nowe możliwości zastosowania badania PET w zróżnicowanych rakach tarczycy wiążą się z możliwością przeprowadzenia badania po podaniu pozytonowego izotopu jodu 124I. Ze względu na wyższą czułość i rozdzielczość uzyskiwanych obrazów w tomografie PET-TK, metoda ta pozwala wykryć mniejsze przerzuty niż w klasycznej scyntygrafii jodem 131I, co więcej, możliwe są badania ilościowe, w tym dozymetryczne. Niestety, jod 124I nie jest jeszcze dostępny na większą skalę.
Rak rdzeniasty tarczycy (RRT)
W przypadku tego nowotworu decydujące znaczenie ma radykalny zabieg operacyjny, nie istnieją formy leczenia uzupełniającego, a próby z zastosowaniem terapii z użyciem izotopów promieniotwórczych (np. 131I-mIBG) mają znaczenie jedynie paliatywne. Także wyniki dotychczas stosowanych schematów chemioterapii nie rokują nadziei na istotną poprawę. Trudności z obrazowaniem przerzutów związane są z jednej strony z istnieniem doskonałego markera raka rdzeniastego, jakim jest stężenie kalcytoniny we krwi. Jej wzrost następuje bardzo szybko, kiedy guz ma jeszcze bardzo małe wymiary, poniżej zdolności rozdzielczej dostępnych metod obrazowych, w tym także i PET-TK. Z drugiej strony metabolizm glukozy jest w raku rdzeniastym zróżnicowany i w części guzów niewystarczający dla skutecznego obrazowania. Dotychczasowe doświadczenia nie są jeszcze zadowalające i wystarczająco liczne. W pracy z 2002 r. grupa węgierska opisała bardzo dobre wyniki (3), ale nie zostały one potwierdzone przez innych badaczy (4, 5).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Palmeto H et al.: Integrated PET-CT In differentiated thyroid cancer. Diagnostic accuracy and impact on patient management. J Nucl Med 2006; 47: 616-24.
2. Leboulleux S et al.: The role of PET In follow-up of patients treated for differentiated epithelial thyroid cancers. Nat Clin Pract Endocrinol Metab 2007; 3: 112-121.
3. Boskich A et al.: Diagnosis In medullary thyroid cancer with 18F-FDG-PET and improvement using a combinated PET-CT scanner. Acta Med Austriaca 2003; 30: 22-25.
4. Szakall S et al.: 18F-FDG PET detection of lymph node metastases in medullary thyroid carcinoma. J Nucl Med 2002; 43(1): 66-71.
5. Faggiano A et al.: Secretive and proliferative tumor helps to select the best imaging technique to identify postoperative persistent or relapsing medullary thyroid cancer. Endocr Rel Cancer 2009; 16(1): 225-231.
6. Aide N, Bardet S: Would patient selection based on both calcitonine blood level and doubling time improve 18F-FDG PET sensitivity in restaging of medullary thyroid cancer? J Nucl Med 2007; 48(4): 501-7.
7. Hoegerle S et al.: 18F-DOPA positron emission tomography for tumour detection In patients with medullary thyroid carcinoma and elevated calcitonin levels. Eur J Nucl Med 2001; 28: 64-71.
8. Bogsrud TV et al.: 18F-FDG PET in the management of patients with anaplastic thyroid carcinoma. Thyroid 2008; 18(7): 713-9.
9. Kayani I et al.: Functional imaging of neuroendocrine tumors with combined PET/CT using 68Ga-DOTATATE (DOTA-Dphe1, Tyr3-octreotate) and 18F-FDG. Cancer 2008; 112(11): 2447-55.
10. Ćwikła JB et al.: Diagnostic imaging approach to gastro-entero-pancreatic carcinomas of neuroendocrine origin-single NET centre experience in Poland. Neuro Endocrinol Lett 2007; 28(6): 789-800.
11. Chong S et al.: Integrated PET/CT of pulmonary neuroendocrine tumors: diagnostic and prognostic implications. AJR Am J Roentgenol 2007; 188(5): 1223-31.
12. Orlefors H et al.: Whole-body (11) C-5-hydroxytryptophan positron emission tomography as a universal imaging technique for neuroendocrine tumors: comparison with somatostatin receptor scintigraphy and computed tomography. J Clin Endocrinol Metab 2005; 90(6): 3392-400.
13. Gabriel M et al.: 68Ga-DOTA-Tyr3-octreotide PET in neuroendocrine tumors: comparison with somatostatin receptor scintigraphy and CT. J Nucl Med 2007; 48(4): 508-18.
14. Shulkin BL et al.: Pheochromocytomas: imaging with 2-[fluorine-18]fluoro-2-deoxy-D-glucose PET. Radiology. 1999; 212(1): 35-41.
15. Havekes B et al.: Detection and treatment of pheochromocytomas and paragangliomas: current standing of MIBG scintigraphy and future role of PET imaging. Q J Nucl Med Mol Imaging 2008; 52(4): 419-29.
16. Bausch B et al.: Genetic and clinical investigation of pheochromocytoma: a 22-year experience, from Freiburg, Germany to international effort. Ann N Y Acad Sci 2006; 1073: 122-37.
17. Becherer A et al.: FDG-PET in adrenocortical carcinoma. Cancer Biother Radiopharm 2001; 16(4): 289-95.
18. Groussin L et al.: 18F-FDG PET for the diagnosis of adrenocortical tumors: a prospective study in 77 operated patients. J Clin Endocrinol Metab 2009 [ahead of print].
19. Caoili EM et al.: Differentiating adrenal adenomas from nonadenomas using (18)F-FDG PET/CT: quantitative and qualitative evaluation. Acad Radiol 2007; 14(4): 468-75.
20. Mackie GC et al.: Use of [18F] fluorodeoxyglucose positron emission tomography in evaluating locally recurrent and metastatic adrenocortical carcinoma. J Clin Endocrinol Metab 2006; 91(7): 2665-71.
21. Leboulleux S et al.: Diagnostic and prognostic value of 18-fluorodeoxyglucose positron emission tomography in adrenocortical carcinoma: a prospective comparison with computed tomography. J Clin Endocrinol Metab 2006; 91(3): 920-5.
22. Soussan M et al.: Impact of FDG PET-CT imaging on the decision making in the biologic suspicion of ovarian carcinoma recurrence. Gyn Oncol 2008; 108: 160-165.
23. Fulham MJ et al.: The impact of PET-CT in suspected recurrent ovarian cancer: A prospective multi-centre study as a part of the Australian PET Data Collection Project. Gyn Oncol 2009; 112: 462-468.
24. Dala PU, Sohaib SA, Huddart R: Imaging of testicular germ cell tumours. Cancer Imaging 2006; 6: 124-134.
25. Oeschle K et al.: [18F] Fluorodeoxyglucose Positron Emission Tomography in Nonseminomatous Germ Cell Tumors After Cehmotherapy: The German Multicenter Positron Emission Tomography Study Group. J Clin Oncol 2008; 26: 5930-5935.
26. Huddart RA et al.: 18Fluorodeoxyglucose Positron Emission Tomography in the Prediction of Relapse in Patients With High-Risk, Clinical Stage I nonseminomatous Germ Cell Tumors: Preliminary Report of MRC Trial TE22 – The NCRI Testis Tumour Clinical Study Group. J Clin Oncol 2007; 25: 3090-2095.




