© Borgis - Postępy Nauk Medycznych 11/2013, s. 812-818
*Magdalena Kochman, Waldemar Misiorowski
Obrazowanie przytarczyc – znaczenie w wyborze postępowania u chorych na pierwotną nadczynność przytarczyc
Parathyroid imaging – implications for management of patients with primary hyperparathyroidism
Klinika Endokrynologii, Centrum Medyczne Kształcenia Podyplomowego, Szpital Bielański, Warszawa
Kierownik Kliniki: prof. dr hab. med. Wojciech Zgliczyński
Streszczenie
Rozwój technik obrazowania sprawił, że obecnie możliwe jest ustalenie położenia około 80-90% powiększonych przytarczyc. Ma to kluczowe znaczenie zwłaszcza w przypadku guzów położonych ektopowo, gdyż ich zlokalizowanie przed operacją warunkuje całkowitą zmianę techniki i zakresu zabiegu. Dodatkowo precyzyjna lokalizacja zmian coraz częściej pozwala na wykonywanie zabiegów małoinwazyjnych (MIP) zamiast klasycznej operacji z eksploracją szyi. Uwidocznienie powiększonej przytarczycy nie warunkuje decyzji o leczeniu operacyjnym, gdyż ta podejmowana jest wyłącznie w oparciu o kryteria kliniczne i biochemiczne. W artykule omówiono stosowane obecnie techniki obrazowania przytarczyc. Badaniem pierwszego rzutu jest ultrasonografia szyi z uwagi na dość dobrą czułość, dostępność, nieinwazyjność i niski koszt. Podstawową rolę odgrywa nadal klasyczna scyntygrafia z zastosowaniem 99mTc-sestamibi. Tomografia komputerowa, a niekiedy także rezonans magnetyczny znajdują zastosowanie, gdy powiększonych przytarczyc nie udaje się uwidocznić przy pomocy ultrasonografii i scyntygrafii, zwłaszcza w przypadkach przetrwałej lub nawrotowej nadczynności przytarczyc. Duże nadzieje wiąże się z rozwojem nowych technik, takich jak tomografia emisyjna pojedynczych fotonów (SPECT) i czterowymiarowa tomografia komputerowa (4D-CT), przydatnych zwłaszcza w sytuacjach trudnych diagnostycznie – powiększenia kilku przytarczyc czy zmian położonych ektopowo. Sporadycznie, u pacjentów po wcześniejszym nieskutecznym leczeniu operacyjnym, u których zawiodły opisane uprzednio techniki obrazowania, wykonuje się arteriografię i cewnikowanie żył z oznaczaniem gradientu stężeń parathormonu.
Summary
The development of imaging techniques nowadays enables localization of 80-90% of enlarged parathyroid glands. This is essential especially in the case of ectopic tumors, as their preoperative imaging implies total change in type and extent of surgical intervention. Furthermore, precise localization of the enlarged gland enables to apply minimally invasive parathyroidectomy (MIP) instead of the classic bilateral cervical exploration. The decision about surgery is not dependent on parathyroid imaging and it is based exclusively on clinical and biochemical criteria. The article discusses currently applicable parathyroid imaging techniques. The first-line imaging study is neck ultrasonography, as it is satisfactory sensitive, available, non-invasive and relatively inexpensive. The classical 99mTc-sestamibi scintigraphy plays still the primary role. Computed tomography and, in some cases, magnetic resonance imaging are used when scintigraphy and sonography fail to localize enlarged parathyroid glands, especially in persisted and recurrent hyperparathyroidism. Emerging techniques of great hopes are single-photon emission computed tomography (SPECT) and 4-dimensional computed tomography (4D-CT), which are useful especially in diagnostically difficult cases of multiglandular disease or ectopic parathyroid glands. Occasionally, in patients after a prior unsuccessful surgery, who have failed previously described imaging techniques, angiography and venous catheterization with determination of parathyroid hormone concentration gradient are performed.

Wstęp
Prawidłowe przytarczyce mają około 2-4 mm szerokości, 0,5-2 mm grubości, 5-10 mm długości, ważą około 20-40 mg i nie są widoczne w większości badań obrazowych (1). Zwykle występują dwie przytarczyce górne, położone do tyłu od górno-środkowej części obu płatów tarczycy i dwie przytarczyce dolne położone do tyłu lub nieco poniżej dolnych biegunów płatów tarczycy. Do 13% pacjentów posiada od jednego do kilku dodatkowych gruczołów przytarczycznych (2). Za powiększone uznaje się przytarczyce o masie > 60 mg, przy czym większość gruczolaków waży > 100 mg (3). Pierwotna nadczynność przytarczyc jest najczęściej powodowana pojedynczym gruczolakiem przytarczycy, jednak w 10-15% przypadków choroba obejmuje więcej gruczołów – zwykle dochodzi wówczas do hiperplazji wszystkich przytarczyc, rzadziej do rozwoju gruczolaków dwóch przytarczyc (4, 5). Od 6 do 16% powiększonych przytarczyc jest położonych ektopowo w obrębie szyi lub śródpiersia (6, 7). Stwierdzenie większej liczby powiększonych przytarczyc, podobnie jak pierwotna nadczynność przytarczyc u osoby młodej, nakazują diagnostykę w kierunku genetycznie warunkowanych zespołów wielogruczołowych (MEN1, MEN2a). Rak przytarczycy jest przyczyną < 1% pierwotnej nadczynności przytarczyc (5, 6).
Obrazowanie przytarczyc przysparza często wiele trudności z uwagi na ich małe rozmiary, zmienność lokalizacji i położenie w okolicy licznych drobnych struktur mylnie interpretowanych jako przytarczyce. Postęp technik wizualizacyjnych sprawił, że obecnie udaje się przedoperacyjnie zlokalizować około 80-90% guzów przytarczyc, zarówno położonych prawidłowo, jak i zmian ektopowych (7). Pozwala to zaplanować rodzaj i zakres zabiegu operacyjnego, a przede wszystkim uniknąć zbędnej eksploracji szyi w przypadku zmian położonych w obrębie klatki piersiowej. Możliwość precyzyjnej lokalizacji powiększonych przytarczyc otworzyła także drogę do rozwoju technik chirurgii małoinwazyjnej (ang. minimal-invasive parathyroidectomy – MIP), co znacząco skraca czas operacji, zmniejsza ryzyko uszkodzenia nerwu krtaniowego wstecznego i występowania pooperacyjnej hipokalcemii związanej z niedokrwieniem pozostałych przytarczyc w trakcie eksploracji szyi, a także zmniejsza koszty leczenia (8).
Operacja przytarczyc jest leczeniem z wyboru u pacjentów z objawową nadczynnością przytarczyc. Rozpowszechnienie badań laboratoryjnych sprawia, że coraz częściej pierwotną nadczynność przytarczyc rozpoznaje się w fazie bezobjawowej. Zgodnie z obecnie obowiązującymi rekomendacjami część tych pacjentów nie ma wskazań do leczenia operacyjnego. W takich przypadkach obrazowanie przytarczyc nie znajduje uzasadnienia, gdyż nie ma wpływu na dalsze postępowanie (6). Żadne z badań lokalizacyjnych nie może być uznane za diagnostyczne dla pierwotnej nadczynności przytarczyc i jedynie w niewielkim stopniu pozwalają one na rozróżnienie jej przyczyny. Jednakże w przypadku kwalifikacji do operacji uwidocznienie pojedynczej powiększonej przytarczycy pozwala na zaplanowanie zabiegu celowanego na tę zmianę. Należy jednocześnie z pełną stanowczością podkreślić, że brak lokalizacji powiększonej przytarczycy w badaniach obrazowych nie stanowi przeciwwskazania do operacji. W zdecydowanej większości takich przypadków chirurg wyspecjalizowany w operacjach przytarczyc (tylko taki powinien operować pacjenta z pierwotną nadczynnością przytarczyc) jest w stanie śródoperacyjnie zlokalizować powiększony gruczoł i skutecznie zoperować.
USG
Ultrasonograficzne obrazowanie przytarczyc zostało wprowadzone do diagnostyki pod koniec lat 70. XX wieku (9). Od tego czasu możliwości obrazowania w ultrasonografii uległy znaczącej poprawie. Zaletami badania ultrasonograficznego są: łatwa dostępność, nieinwazyjność, nienarażanie pacjenta na promieniowanie rentgenowskie i niski koszt. Dodatkowo pozwala ono uwidocznić obecność ewentualnych patologii w obrębie tarczycy, takich jak guzy czy zapalenie, które występują u około połowy pacjentów z pierwotną nadczynnością przytarczyc oraz ocenić inne struktury szyi, w tym węzły chłonne, co może mieć istotne znaczenie między innymi w interpretacji wyników scyntygrafii (10).
W diagnostyce przytarczyc stosowane są głowice liniowe o częstotliwości 5-15 MHz, standardowo używane do obrazowania tarczycy. W trakcie badania pacjent znajduje się w pozycji leżącej z głową odchyloną ku tyłowi. Ma to istotne znaczenie zwłaszcza dla uwidocznienia przytarczyc dolnych. Standardowy obszar badania rozciąga się od wysokości kości gnykowej do wcięcia jarzmowego mostka i stawów mostkowo-obojczykowych, zaś bocznie jest ograniczony przez tętnice szyjne wspólne i żyły szyjne wewnętrzne. O ile nie uwidoczniono powiększonej przytarczycy, obszar badania należy rozszerzyć w górę aż do kątów żuchwy i podjąć próbę oceny śródpiersia górnego. W wizualizacji przytarczyc pomóc może zmiana pozycji głowy lub przełykanie śliny przez pacjenta. Niestety ultrasonografia wykazuje niewielką zdolność do wykrywania ektopowych przytarczyc, z uwagi na brak możliwości oceny zmian położonych za strukturami kostnymi i upowietrznionymi (tchawica, przełyk). Powiększone przytarczyce mają zwykle wygląd owalnych lub okrągłych jednorodnych struktur litych, wyraźnie hipoechogenicznych w stosunku do tarczycy (ryc. 1) (11). Niekiedy są one modelowane przez sąsiadujące struktury – tarczycę i tętnice szyjne. Zwykle od tarczycy oddziela je wyraźne hiperechogeniczne pasmo torebki łącznotkankowej. Niekiedy, zwłaszcza duże zmiany, mogą przybierać policykliczne, nieregularne kształty, mają niejednorodną, nieco wyższą echogeniczność, stwierdza się w nich obecność przestrzeni płynowych, pasm zwłóknień i zwapnień (ryc. 2). W badaniu metodą Dopplera charakteryzują się wzmożonym obwodowo-centralnym przepływem, z pojedynczym naczyniem doprowadzającym, dochodzącym do górnego lub dolnego bieguna zmiany i rozgałęziającym się na okalające ją częściowo naczynia. W zmianach o średnicy < 10 mm przepływ centralny może być trudny do uwidocznienia. W większości przypadków przytarczyce unaczynione są przez odnogi tętnic tarczowych. Identyfikacja tętnicy doprowadzającej krew do zmiany jest trudna, jednak zwiększa czułość o 10%, a swoistość aż o 54% (12).
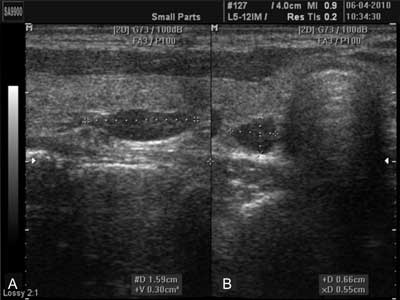
Ryc. 1. Badanie ultrasonograficzne szyi. Eutopowo położony guz przytarczycy dolnej prawej. A – przekrój podłużny, B – przekrój poprzeczny.
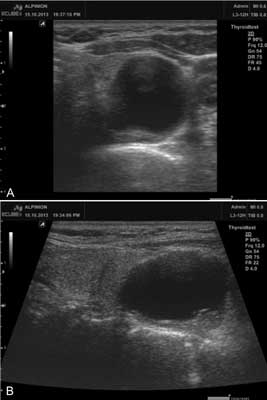
Ryc. 2. Badanie ultrasonograficzne szyi. Do tyłu i nieco poniżej dolnego bieguna płata lewego tarczycy guz przytarczycy z dużą przestrzenią płynową uciskający i przemieszczający lewy płat tarczycy ku górze. A – przekrój poprzeczny, B – przekrój podłużny (obrazowanie panoramiczne).
Trudności w uwidocznieniu przytarczyc mogą dotyczyć pacjentów z wolem guzowatym dużych rozmiarów, po zabiegach operacyjnych i leczeniu 131I. W przypadku przytarczycy położonej wewnątrztarczycowo usg nie jest w stanie odróżnić jej od guza tarczycy (ryc. 3). Trudności w odróżnieniu przytarczycy od guza tarczycy mogą występować również, gdy przytarczyca leży na tylnej powierzchni tarczycy wewnątrz jej torebki. W takich sytuacjach, jak również w innych przypadkach wątpliwych pomocna może być biopsja cienkoigłowa pod kontrolą usg z oceną stężenia PTH w popłuczynach z igły biopsyjnej. Stwierdzenie wyższego stężenia PTH w popłuczynach z igły biopsyjnej niż w surowicy potwierdza, że uwidoczniona ultrasonograficznie zmiana jest przytarczycą (13).
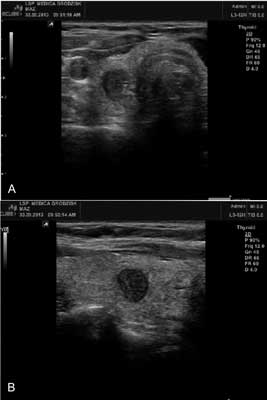
Ryc. 3. Badanie ultrasonograficzne szyi. Guz przytarczycy położony wewnątrz prawego płata tarczycy. A – przekrój poprzeczny, B – przekrój podłużny.
Czułość ultrasonografii w diagnostyce pierwotnej nadczynności przytarczyc wynosi 70-90% (12). W metaanalizie obejmującej ponad 20 000 pacjentów z pierwotną nadczynnością przytarczyc czułość usg w przypadku pojedynczego gruczolaka określono na 79%, jednak była ona znacznie niższa w przeroście czterogruczołowym (35%), a w przypadku współistnienia dwóch gruczolaków wynosiła zaledwie 16% (4). Swoistość usg oceniana jest na 90-98% (12, 14).
Wyniki fałszywie dodatnie stwierdza się w przypadku guzków tarczycy i powiększonych węzłów chłonnych. Niekiedy błędnie jako powiększona przytarczyca opisywany bywa przełyk, mięsień długi szyi lub żyły okołotarczycowe.
Wyniki fałszywie ujemne są zwykle wynikiem niewielkich rozmiarów gruczołu, jego ektopowego położenia lub trudnych warunków badania związanych z dużym wolem, przebytą operacją szyi, dużą ilością tkanki podskórnej, krótką szyją bądź niemożnością przyjęcia przez pacjenta właściwej pozycji do badania.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Grimelius L, Bondeson L: Histopathological diagnosis of parathyroid diseases. Pathol Res Pract 1995; 191(4): 353-365.
2. Akerström G, Malmaeus J, Bergström R: Surgical anatomy of human parathyroid glands. Surgery 1984; 95(1): 14-21.
3. Kunstman JW, Kirsch JD, Mahajan A, Udelsman R: Clinical review: Parathyroid localization and implications for clinical management. J Clin Endocrinol Metab 2013; 98(3): 902-912.
4. Ruda JM, Hollenbeak CS, Stack BC Jr: A systematic review of the diagnosis and treatment of primary hyperparathyroidism from 1995 to 2003. Otolaryngol Head Neck Surg 2005; 132(3): 359-372.
5. Misiorowski W: Pierwotna nadczynność przytarczyc. [W:] Zgliczyński W (red.): Endokrynologia. Część I. Medical Tribune Polska, Warszawa 2011: 364-373.
6. Pitayakorn R, McHenry CR: Incidence and location of ectopic abnormal parathyroid glands. Am J Surg 2006; 191(3): 418-423.
7. Roy M, Mazeh H, Chen H, Sippel RS: Incidence and localization of ectopic parathyroid adenomas in previously unexplored patients. World J Surg 2013; 37(1): 102-106.
8. Udelsman R, Lin Z, Donovan P: The superiority of minimally invasive parathyroidectomy based on 1650 consecutive patients with primary hyperparathyroidism. Ann Surg 2011; 253(3): 585-591.
9. Sample WF, Mitchell SP, Bledsoe RC: Parathyroid ultrasonography. Radiology 1978; 127(2): 485-490.
10. Morita SY, Somervell H, Umbricht CB et al.: Evaluation for concomitant thyroid nodules and primary hyperparathyroidism in patients undergoing parathyroidectomy or thyroidectomy. Surgery 2008; 144(6): 862-866.
11. Huppert BJ, Reading CC: Parathyroid sonography: imaging and intervention. J Clin Ultrasound 2007; 35(3): 144-155.
12. Lane MJ, Desser TS, Weigel RJ, Jeffrey RB Jr: Use of color and power Doppler sonography to identify feeding arteries associated with parathyroid adenomas. AJR Am J Roentgenol 1998; 171(3): 819-823.
13. Sacks BA, Pallotta JA, Cole A, Hurwitz J: Diagnosis of parathyroid adenomas: efficacy of measuring parathormone levels in needle aspirates of cervical masses. AJR Am J Roentgenol 1994; 163(5): 1223-12236.
14. Tublin ME, Pryma DA, Yim JH et al.: Localization of parathyroid adenomas by sonography and technetium tc-99m sestamibi single-photon emission computed tomography before minimally invasive parathyroidectomy: are both studies really needed? J Ultrasound Med 2009; 28(2): 183-190.
15. Fukunaga M, Morita R, Yonekura Y et al.: Accumulation of 201Tl-chloride in a parathyroid adenoma. Clin Nucl Med 1979; 4(6): 229-230.
16. Coakley AJ, Kettle AG, Wells CP et al.: 99Tcm sestamibi – a new agent for parathyroid imaging. Nucl Med Commun 1989; 10(11): 791-794.
17. Eslamy HK, Ziessman HA: Parathyroid scintigraphy in patients with primary hyperparathyroidism: 99mTc sestamibi SPECT and SPECT/CT. Radiographics 2008; 28(5): 1461-1476.
18. Hauty M, Swartz K, McClung M, Lowe DK: Technetium-thallium scintiscanning for localization of parathyroid adenomas and hyperplasia. A reappraisal. Am J Surg 1987; 153(5): 479-486.
19. Caveny SA, Klingensmith WC 3rd, Martin WE et al.: Parathyroid imaging: the importance of dual-radiopharmaceutical simultaneous acquisition with 99mTc-sestamibi and 123I. J Nucl Med Technol 2012; 40(2): 104-110.
20. Ishibashi M, Nishida H, Strauss HW et al.: Localization of parathyroid glands using technetium-99m-tetrofosmin imaging. J Nucl Med 1997; 38(5): 706-711.
21. Taillefer R, Boucher Y, Potvin C, Lambert R: Detection and localization of parathyroid adenomas in patients with hyperparathyroidism using a single radionuclide imaging procedure with technetium-99m-sestamibi (double-phase study). J Nucl Med 1992; 33(10): 1801-1807.
22. Erbil Y, Barbaros U, Yanik BT et al.: Impact of gland morphology and concomitant thyroid nodules on preoperative localization of parathyroid adenomas. Laryngoscope 2006; 116(4): 580-585.
23. Sukan A, Reyhan M, Aydin M et al.: Preoperative evaluation of hyperparathyroidism: the role of dual-phase parathyroid scintigraphy and ultrasound imaging. Ann Nucl Med 2008; 22(2): 123-131.
24. Behrendt FF, Verburg FA, Prechtel HW et al.: Pulmonary adenocarcinoma as a random finding in (99m)Tc-MIBI parathyroid scintigraphy. Hell J Nucl Med 2012 Sep-Dec; 15(3): 254-255.
25. Krausz Y, Shiloni E, Bocher M et al.: Diagnostic dilemmas in parathyroid scintigraphy. Clin Nucl Med 2001; 26(12): 997-1001.
26. Erbil Y, Barbaros U, Tükenmez M et al.: Impact of adenoma weight and ectopic location of parathyroid adenoma on localization study results. World J Surg 2008; 32(4): 566-571.
27. Ruf J, Lopez Hänninen E, Steinmüller T et al.: Preoperative localization of parathyroid glands. Use of MRI, scintigraphy, and image fusion. Nuklearmedizin 2004; 43(3): 85-90.
28. Kunstman JW, Kirsch JD, Mahajan A, Udelsman R: Clinical review: Parathyroid localization and implications for clinical management. J Clin Endocrinol Metab 2013; 98(3): 902-912.
29. Cheung K, Wang TS, Farrokhyar F et al.: A meta-analysis of preoperative localization techniques for patients with primary hyperparathyroidism. Ann Surg Oncol 2012; 19(2): 577-583.
30. Harari A, Zarnegar R, Lee J et al.: Computed tomography can guide focused exploration in select patients with primary hyperparathyroidism and negative sestamibi scanning. Surgery 2008; 144(6): 970-976.
31. Starker LF, Mahajan A, Björklund P et al.: 4D parathyroid CT as the initial localization study for patients with de novo primary hyperparathyroidism. Ann Surg Oncol 2011; 18(6): 1723-1728.
32. Pata G, Casella C, Magri GC et al.: Financial and clinical implications of low-energy CT combined with 99m Technetium-sestamibi SPECT for primary hyperparathyroidism. Ann Surg Oncol 2011; 18(9): 2555-2563.
33. Wakamatsu H, Noguchi S, Yamashita H et al.: Parathyroid scintigraphy with 99mTc-MIBI and 123I subtraction: a comparison with magnetic resonance imaging and ultrasonography. Nucl Med Commun 2003; 24(7): 755-762.
34. Michel L, Dupont M, Rosière A et al.: The rationale for performing MR imaging before surgery for primary hyperparathyroidism. Acta Chir Belg 2013; 113(2): 112-122.
35. Lee VS, Spritzer CE, Coleman RE et al.: The complementary roles of fast spin-echo MR imaging and double-phase 99m Tc-sestamibi scintigraphy for localization of hyperfunctioning parathyroid glands. AJR Am J Roentgenol 1996; 167(6): 1555-1562.
36. Lee VS, Spritzer CE: MR imaging of abnormal parathyroid glands. AJR Am J Roentgenol 1998; 170(4): 1097-1103.
37. Oksüz MO, Dittmann H, Wicke C et al.: Accuracy of parathyroid imaging: a comparison of planar scintigraphy, SPECT, SPECT-CT, and C-11 methionine PET for the detection of parathyroid adenomas and glandular hyperplasia. Diagn Interv Radiol 2011; 17(4): 297-307.
38. Caldarella C, Treglia G, Isgrò MA, Giordano A: Diagnostic performance of positron emission tomography using 11C-methionine in patients with suspected parathyroid adenoma: a meta-analysis. Endocrine 2013; 43(1): 78-83.
39. Weber T, Maier-Funk C, Ohlhauser D et al.: Accurate preoperative localization of parathyroid adenomas with C-11 methionine PET/CT. Ann Surg 2013; 257(6): 1124-1128.
40. Miller DL: Endocrine angiography and venous sampling. Radiol Clin North Am 1993 Sept; 31(5): 1051-1067.



